
【题目】在恒容的密闭容器内,使 1molN2和3molH2 混合发生下列反应:
3H2+N2![]() 2NH3 H<0
2NH3 H<0
(1) 升高温度时,混合气体的密度_____。(填:“变大”或“变小”或“不变”)
(2)当达到平衡时,充入 N2,平衡将_____移动。(填:“正向”或“逆向”或“不”, 下同)
(3)当达到平衡时,充入Ar气,平衡将_____移动。
(4)当达到平衡时,将 c(N2)、c(H2)、c(NH3)同时增大 1 倍,平衡将_____移动。
【答案】不变 正向 不 正向
【解析】
本题主要考察勒夏特列原理在化学平衡中的运用,通过分析反应体系浓度的变化,结合压强与浓度的关系,以及压强对化学平衡的影响,可以解答本题:
(1)改变温度平衡移动,但不改变质量;
(2)充氮气增大了反应物的浓度;
(3)体积不变时充入Ar不改变反应体系各物质的浓度;
(4)同等倍数增大浓度相当于加压。
据此解答。
(1)根据密度公式:![]() ,该体系容积不变、质量不变,所以密度不变,故答案为:不变。
,该体系容积不变、质量不变,所以密度不变,故答案为:不变。
(2)根据勒夏特列原理,增大反应物N2的浓度时,平衡向正向移动,故答案为:正向。
(3)恒容时,在平衡体系中充入无关气体,虽能使总压强增大,但反应物和生成物的分压不变、浓度不变,正反应速率和逆反应速率均不变,所以平衡不移动,故答案为:不。
(4)同等倍数的增大各物质的浓度,相当于在原平衡的基础上加压,所以平衡向正向移动,故答案为:正向。


科目:高中化学 来源: 题型:
【题目】磷石膏是硫酸分解磷矿制取磷酸过程中的副产物,其主要组分为CaSO4,氢气还原分解硫酸钙的部分反应如下:
①2CaSO4(s)=2CaO(s)+2SO2(g)+O2(g) ΔH1=akJ·mol-1
②CaSO4(s)+H2(g)=CaO(s)+H2O(l)+SO2(g) ΔH2=bkJ·mol-1
③CaSO4(s)+4H2(g)=CaS(s)+4H2O(l) ΔH3=ckJ·mol-1
④3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) ΔH4=dkJ·mol-1
下列说法正确的是( )
A.反应①中a<0
B.反应③在常温下能自发进行,说明c>0
C.c=4b-d
D.反应H2(g)+![]() O2(g)=H2O(l)的△H=(2b-a)kJmol-1
O2(g)=H2O(l)的△H=(2b-a)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.NaHCO3 = Na++H++CO32-
B.(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
C.H2S![]() 2H++S2-
2H++S2-
D.Al(OH)3![]() H++AlO2-+H2O
H++AlO2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
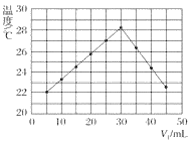
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法不正确的是
A.醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等。
B.1mol钠与足量氧气在不同条件下反应生成Na2O或Na2O2均失去NA个电子
C.1L1mol/LCuCl2溶液中含有的Cu2+的个数为NA。
D.25℃,1.01×105Pa时,16g臭氧所含的原子数为NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/LCuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K。
酸液都取足量、相同体积,请你帮助完成下面实验设计表(表中不留空格):
实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
① | 298 | 0.20mol/L |
| a.实验①和②是探究_____对锌与盐酸反应速率的影响; b.实验①和③是探究_____对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同 浓度的盐酸、醋酸与锌反应速率的区别 |
② | 308 | 0.20mol/L |
| |
③ | 298 | 0.40mol/L |
| |
④ | ______ |
| 0.20mol/L |
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如下图:
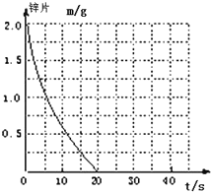
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.____________________________
(3)某实验小组在做(1)中实验④时误加少量0.10mol/LCuCl2溶液,发现反应速率与(1)中实验①接近,加少量0.10mol/LCuCl2溶液后速率变快的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖得主——德国科学家格哈德·埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将CO、NO、NO2和碳氢化合物等转化无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是

A.催化转化器中的铂催化剂可加快CO氧化
B.铂表面做成蜂窝状更有利于提高催化效果。
C.在铂催化下,NO、NO2可被CO还原成N2
D.碳氢化合物在铂催化下,被CO直接氧化成CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗干净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸20. 00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作一次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_____________________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是__________________________________________。
(3)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | |||
① | 20 | 1.02 | 21.03 | |
② | 20 | 2.00 | 25.00 | |
③ | 20 | 0.61 | 20.60 | |
滴定中误差较大的是第_______次实验,造成这种误差的可能原因是_______。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为________mol/L。
(5)如果准确移取20. 00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?______________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为![]() ,下列有关该电池的说法错误的是( )
,下列有关该电池的说法错误的是( )
A.电池的电解液为碱性溶液,正极为![]() 、负极为
、负极为![]()
B.电池放电时,正极反应为![]()
C.电池充电过程中,阴极附近溶液的![]() 升高
升高
D.电池充电时,阳极反应为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com