
| A、5a=2b |
| B、2a=5b |
| C、3a=2b |
| D、2a=3b |
| m |
| M |
| 100g |
| 100g/mol |
| 100g |
| 40g/mol |


科目:高中化学 来源: 题型:
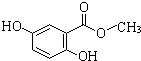
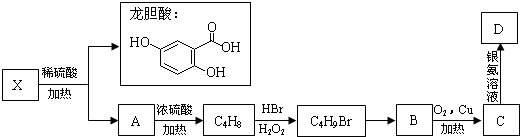
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质都是离子化合物,弱电解质都是共价化合物? |
| B、强电解质都是可溶性化合物,弱电解质都是难溶性化合物? |
| C、强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子? |
| D、强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- |
| B、向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- |
| C、向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的红色石蕊试纸靠近试管口,若试纸不变蓝,则说明该溶液中无NH4+ |
| D、如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥⑦ | B、③⑤⑦⑧ |
| C、①③⑦⑧ | D、③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光 |
| A、蒸馏法 | B、水洗分液法 |
| C、过滤法 | D、有机溶剂萃取法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
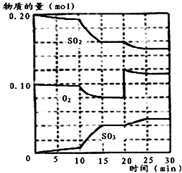 已知一定条件下在1L的密封容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H<0,反应过程中SO2、O2、SO3物质的量变化如图,请根据图示回答下列问题:
已知一定条件下在1L的密封容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H<0,反应过程中SO2、O2、SO3物质的量变化如图,请根据图示回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com