
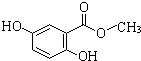
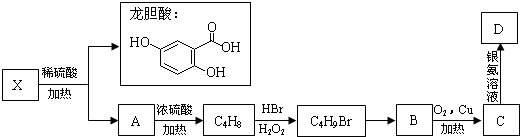
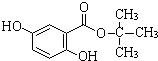
 ,A发生消去反应生成(CH3)2C=CH2,B能催化氧化生成C,C能发生银镜反应,故B中-OH连接的碳原子上含有2个H原子,则(CH3)2C=CH2与HBr发生加成反应生成(CH3)2CHCH2Br,则B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,D为(CH3)2CHCOOH,据此解答.
,A发生消去反应生成(CH3)2C=CH2,B能催化氧化生成C,C能发生银镜反应,故B中-OH连接的碳原子上含有2个H原子,则(CH3)2C=CH2与HBr发生加成反应生成(CH3)2CHCH2Br,则B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,D为(CH3)2CHCOOH,据此解答. ,
, ;
; ,A发生消去反应生成(CH3)2C=CH2,B能催化氧化生成C,C能发生银镜反应,故B中-OH连接的碳原子上含有2个H原子,则(CH3)2C=CH2与HBr发生加成反应生成(CH3)2CHCH2Br,则B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,D为(CH3)2CHCOOH,
,A发生消去反应生成(CH3)2C=CH2,B能催化氧化生成C,C能发生银镜反应,故B中-OH连接的碳原子上含有2个H原子,则(CH3)2C=CH2与HBr发生加成反应生成(CH3)2CHCH2Br,则B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,D为(CH3)2CHCOOH, ,故答案为:
,故答案为: ;
;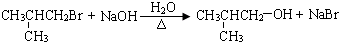 ,
, ;
;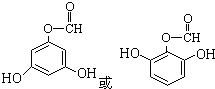 ,故答案为
,故答案为 .
.


科目:高中化学 来源: 题型:
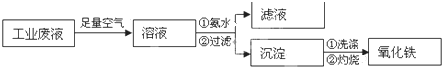
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
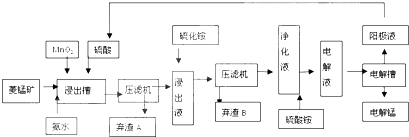
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
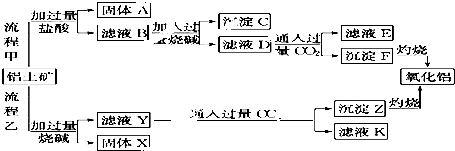
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏 | B、分液 | C、过滤 | D、蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中多加着色剂 |
| B、为保证人体所需足够蛋白质我们要多吃肉,少吃蔬菜和水果 |
| C、食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿 |
| D、为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3 | B、4 | C、5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5a=2b |
| B、2a=5b |
| C、3a=2b |
| D、2a=3b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com