
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
| ||
| ||
| 3 |
| ||
| ||
| ||


科目:高中化学 来源: 题型:
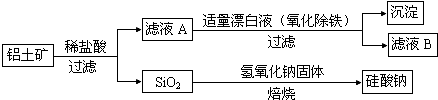

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
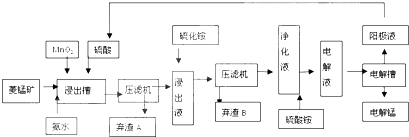
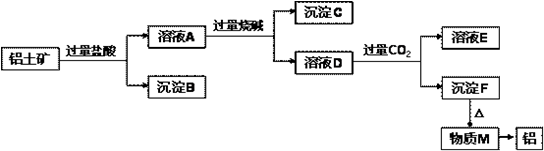
 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图所示,请回答下列问题:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
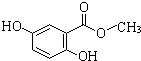
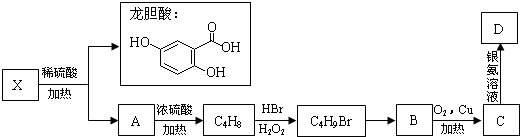
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的分馏是将相对分子质量较大分子变成相对分子质量较小分子的过程 |
| B、石油裂化可提高汽油、煤油和柴油等轻质油的产量 |
| C、石油分馏、裂化、裂解获得的产品都是混合物 |
| D、石油是工业的血液,但石油化工及其产品也对生态环境产生了不良影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质都是离子化合物,弱电解质都是共价化合物? |
| B、强电解质都是可溶性化合物,弱电解质都是难溶性化合物? |
| C、强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子? |
| D、强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com