
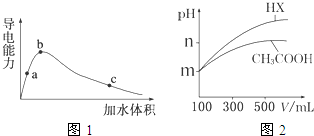
| cCH3COO- |
| cCH3COOH |
| C(CH 3COO -)C(H +) |
| C(CH3COOH) |
| cCH3COO- |
| cCH3COOH |


科目:高中化学 来源: 题型:
| A、强电解质一定是离子化合物,弱电解质一定是共价化合物 |
| B、强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 |
| C、CO2的水溶液导电能力很弱,所以CO2是弱电解质 |
| D、属于共价化合物的电解质在熔化状态下一般不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
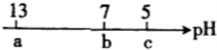 向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a.b、c三点的pH为实验中所测得,下列有关说法中一定正确的是( )
向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a.b、c三点的pH为实验中所测得,下列有关说法中一定正确的是( )| A、.当7<pH<13时,溶液中c(Na)>c(CH3COO)>c(OH)>C(H) |
| B、.当pH=7时,所加CH3COOH溶液的体积为10 mL |
| C、当5<pH<7时,溶液中c(CH3COO)>c(Na) |
| D、.继续滴加0.1 mol?L-1的CH3COOH溶液,溶液的pH最终可以变化至1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
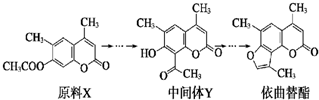
| A、原料X与中间体Y互为同分异构体 |
| B、原料X可以使酸性KMnO4溶液褪色 |
| C、中间体Y能发生加成、取代、消去反应 |
| D、1 mol依曲替酯只能与1 mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 操 作 | 现 象 | 实 验 结 论 | |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 将某气体通入澄清石灰水中 | 变浑浊 | 该气体一定是CO2 |
| C | 向某溶液中加入2滴KSCN溶液; | 溶液不显红色; | 溶液中一定含有Fe2+ |
| 另取样,先滴入氯水,再滴入KSCN溶液 | 溶液变为红色 | ||
| D | 将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热 | 有银镜生成 | 该物质一定是葡萄糖 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2能支持燃烧 |
| B、NO2不能支持燃烧 |
| C、木条复燃是因为硝酸铜分解产生了氧气的缘故 |
| D、木条复燃是因为硝酸铜分解产生了氧气和二氧化氮共同作用的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com