
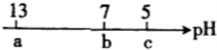 向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a.b、c三点的pH为实验中所测得,下列有关说法中一定正确的是( )
向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a.b、c三点的pH为实验中所测得,下列有关说法中一定正确的是( )| A、.当7<pH<13时,溶液中c(Na)>c(CH3COO)>c(OH)>C(H) |
| B、.当pH=7时,所加CH3COOH溶液的体积为10 mL |
| C、当5<pH<7时,溶液中c(CH3COO)>c(Na) |
| D、.继续滴加0.1 mol?L-1的CH3COOH溶液,溶液的pH最终可以变化至1 |


科目:高中化学 来源: 题型:
| A、水的摩尔质量是18g |
| B、标准状况下,1.8L CCl4和1.8L NH3所含分子个数相同 |
| C、在标准状况下,1mol任何物质的体积都约为22.4L |
| D、将73gHCl溶于水中配成1L溶液,所得溶液物质的量浓度是2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁是位于第四周期第ⅧB族的元素,是一种重要的过渡元素 |
| B、向浅绿色的Fe(NO3)2溶液中加入盐酸,溶液变黄 |
| C、14 g铁粉和7 g硫粉在空气中充分反应能生成21 g 硫化亚铁 |
| D、四氧化三铁可以看成是氧化铁和氧化亚铁组成的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
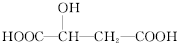 ,下列说法正确的是( )
,下列说法正确的是( )A、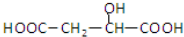 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
| B、1 mol苹果酸可与3 mol NaOH发生中和反应 |
| C、1 mol苹果酸与足量金属Na反应生成1 mol H2 |
| D、四联苯的一氯代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
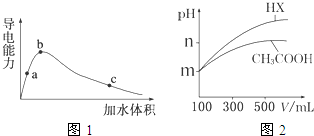
| cCH3COO- |
| cCH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com