
| 5cmol/L×0.02400L×1 |
| 6 |
0.02cmol×
| ||
| Wg |
0.02cmol×
| ||
| Wg |
| Ksp |
| C(Fe2+) |
| 6.25×10-18 |
| 1 |
|


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质一定是离子化合物,弱电解质一定是共价化合物 |
| B、强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 |
| C、CO2的水溶液导电能力很弱,所以CO2是弱电解质 |
| D、属于共价化合物的电解质在熔化状态下一般不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(SO2):n(O2)=2:1 |
| B、反应达到平衡后,缩小容器体积,正反应速率加快,逆反应速率减慢,平衡正向移动 |
| C、反应达到平衡时,加入催化剂,速率加快,平衡常数增大 |
| D、当v正(SO2):v正(SO3)=1:1时,说明该化学反应已经达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
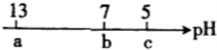 向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a.b、c三点的pH为实验中所测得,下列有关说法中一定正确的是( )
向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a.b、c三点的pH为实验中所测得,下列有关说法中一定正确的是( )| A、.当7<pH<13时,溶液中c(Na)>c(CH3COO)>c(OH)>C(H) |
| B、.当pH=7时,所加CH3COOH溶液的体积为10 mL |
| C、当5<pH<7时,溶液中c(CH3COO)>c(Na) |
| D、.继续滴加0.1 mol?L-1的CH3COOH溶液,溶液的pH最终可以变化至1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com