
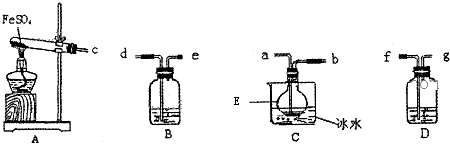
| ||
| cg |
| 233g/mol |
| c |
| 233 |
| ||
| 2c |
| 233 |
| 2c |
| 233 |
| 2c |
| 233 |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
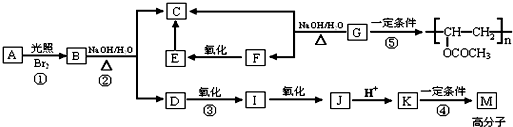
查看答案和解析>>
科目:高中化学 来源: 题型:
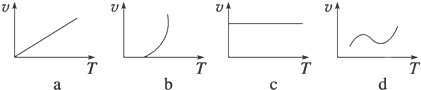
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
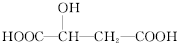 ,下列说法正确的是( )
,下列说法正确的是( )A、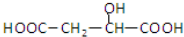 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
| B、1 mol苹果酸可与3 mol NaOH发生中和反应 |
| C、1 mol苹果酸与足量金属Na反应生成1 mol H2 |
| D、四联苯的一氯代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
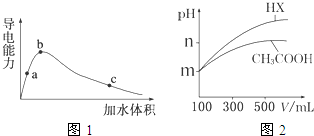
| cCH3COO- |
| cCH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、②③④ |
| C、①③④ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、OH-、Cl- |
| B、Ba2+、Na+、CO32-、NO3- |
| C、Mg2+、Na+、SO42-、Cl- |
| D、K+、NH4+、Cl-、Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com