
【题目】恒定温度为T1℃时,在容积为10 L的密闭容器中充人1.0mol X和0.80 mol Y,发生反应:2X(g) + Y(g) ![]() 2Z(g),X的转化率随时间的变化关系如右图所示。
2Z(g),X的转化率随时间的变化关系如右图所示。
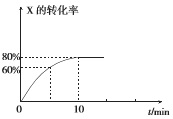
(1)第2 min时的反应速率v1(X)_________(填“大于”、“小于”或“等于”)第8 min时的反应速率可v2(X),原因是_________________。
(2)反应在0~10 min内Y的平均反应速率v(Y)=________mol.L-1.min-l。
(3)T1℃温度下反应的平衡常数K1为___________,若在第10 min后压缩容器容积,X的转化率_________(填“增大”、“减小”或“不变”,下同),平衡常数____________。
(4)若升高温度到T2℃( T2>T1),平衡时X的转化率减小,则该反应的△H______0(填 “大于”或“小于”)。
(5)不改变各物质起始量的情况下,无论如何改变条件,Y的转化率一定小于____________。
【答案】(1)大于,随反应进行,X的浓度逐渐减小;(2)0.004;(3)400,增大,不变;(4)小于;(5)62.5%。
【解析】
试题分析:(1)浓度对化学反应速率的影响,浓度越大反应速率越快,随着反应的进行,化学反应速率降低,因此第2min的v1(X)>v2(X);(2)此时间段内消耗X的物质的量为1×80%mol=0.8mol,消耗的Y的物质的量为0.8/2mol=0.4mol,根据化学反应速率的表达式,v(B)=0.4/(10×10) mol/ (L·min) = 0.004 mol/(L·min);
(3) 2X(g)+Y(g)![]() 2Z(g)
2Z(g)
起始: 1 0.8 0
变化: 2x x 2x
平衡:1-2x 0.8-x 2x
达到平衡时,消耗的B的物质的量为0.4mol,达到平衡是c(X)=(1-2×0.4)/10mol·L-1=0.02mol·L-1,c(B)=(0.8-0.4)/10mol·L-1=0.04mol·L-1,c(Z)=2×0.4/10mol·L-1=0.08mol·L-1,根据化学平衡常数的表达式,K=0.082/[0.04×0.022]=400,压缩体积,增大压强,平衡向体积减小的方向移动,即向正反应方向移动,X的转化率增大,化学平衡常数只受温度的影响,因此增大压强,平衡常数不变;(4)升高温度,X的转化率降低,说明反应向逆方向移动,根据勒夏特列原理,正反应方向是放热反应,即△H<0;(5)根据量的投入,X是不足,假设X全部转化,则消耗B的物质的量为1/2mol=0.5mol,此时B的转化率为0.5/0.8×100%=62.5%,此反应是可逆反应,不能进行到底,因此B的转化率一定小于62.5%。


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 1molH2O的质量为18g.mol-1
B. CH4的摩尔质量为16g
C. 3.01×1023个SO2分子的质量为32g
D. 标准状况下,1mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应均为放热反应,其中反应热最小的是
A. 2A(l) + B(l) = 2C (g) △H1
B. 2A(g) + B(g) = 2C(g) △H2
C. 2A (g) + B ( g ) = 2C(l) △H3
D. 2A (l) + B(l)= 2C(l) △H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。[来
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)ΔH1=+156.6 kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH==CH2(g)+H2(g)的ΔH_______kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为________________;放电时,CO32—移向电池的________(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的二级电离,则H2CO3![]() HCO3—+H+的平衡常数K1=__________。(已知:10-5.60=2.5×10-6)
HCO3—+H+的平衡常数K1=__________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3)_____________c(CO32—)(填“>”、“=”或“<”),原因是___________________(用离子方程式和必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示:△H1=-393.5kJmol-1,△H2=-395.4kJmol-1,下列说法正确的是( )
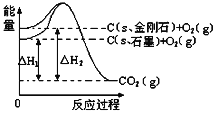
A. 石墨转化为金刚石是放热反应
B. 石墨和金刚石的相互转化是物理变化
C. 金刚石的稳定性强于石墨
D. 等质量的石墨与金刚石完全燃烧,金刚石放出的能量更多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A. 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA
B. 标准状况下,22.4 L的CCl4中C—Cl键数为4NA
C. 1mol N5+ 含有的电子数为34NA
D. 4℃时,18g2H216O中含有共用电子对数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据某种共性,可将CO2、SO2归为一类氧化物。下列物质中,也属于同类氧化物的是( )
A.CaCO3 B.SO3 C.CuO D.KMnO4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是

A. 拆开2molH2(g)和1molO2(g)中的化学键,共放出1368kJ能量
B. 1molH2和0.5molO2的能量之和比1molH2O(l)的能量大242kJ
C. 2H2O(g)=2H2(g)+O2(g) △H=484kJ/mol
D. 2H2(g)+O2(g)=2H2O(l) △H=572kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com