
【题目】相同质量的下列烃,完全燃烧时,需要氧气最少的是( )
A.CH4
B.C2H4
C.C3H6
D.C2H2
科目:高中化学 来源: 题型:
【题目】能源紧张、资源短缺、环境恶化是当今世界面临的三大问题,下列说法错误的是
A.电池外壳的金属材料回收再利用
B.将地沟油回收再加工为食用油,提高资源的利用率
C.目前我国使用的主要能源是化石燃料,化石燃料属于不可再生能源
D.能源的开发和利用情况,可以衡量一个国家或地区的经济发展和科学技术水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g)![]() 2HI(g)△H=-9.48kJmol-1
2HI(g)△H=-9.48kJmol-1
②I2(s)+H2(g)![]() 2HI(g)△H=+26.48kJmol-1.下列判断正确的是
2HI(g)△H=+26.48kJmol-1.下列判断正确的是
A.反应①的产物比反应②的产物稳定
B.254g I2(g)中通入2g H2(g),反应放热9.48kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下表,下列说法错误的是( )

A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,平衡常数为1600
2Z,平衡常数为1600
C.其他条件不变时,增大压强可使平衡常数增大
D.改变温度可以改变该反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2 CO2(g) △H=-566.00kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式_________________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化的关系如右图所示。
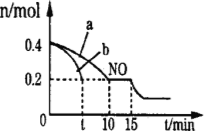
①T℃时该化学反应的平衡常数K=_______________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将_______移动。(填“向左”、“向右”或“不)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_______。
Ⅱ.SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-。该反应的离子方程式是___________________。
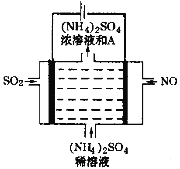
(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_____________,阴极的电极反应式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 化学反应的反应热与反应过程有密切的关系
B. 化学反应的反应热取决于反应体系的始态和终态
C. 盖斯定律只是一条简单的自然规律,其实际作用不大
D. 有的化学反应过程没有能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒定温度为T1℃时,在容积为10 L的密闭容器中充人1.0mol X和0.80 mol Y,发生反应:2X(g) + Y(g) ![]() 2Z(g),X的转化率随时间的变化关系如右图所示。
2Z(g),X的转化率随时间的变化关系如右图所示。
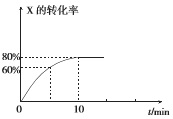
(1)第2 min时的反应速率v1(X)_________(填“大于”、“小于”或“等于”)第8 min时的反应速率可v2(X),原因是_________________。
(2)反应在0~10 min内Y的平均反应速率v(Y)=________mol.L-1.min-l。
(3)T1℃温度下反应的平衡常数K1为___________,若在第10 min后压缩容器容积,X的转化率_________(填“增大”、“减小”或“不变”,下同),平衡常数____________。
(4)若升高温度到T2℃( T2>T1),平衡时X的转化率减小,则该反应的△H______0(填 “大于”或“小于”)。
(5)不改变各物质起始量的情况下,无论如何改变条件,Y的转化率一定小于____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )

A. X与M形成的一个阴离子中含有29个电子
B. 气态氢化物沸点Y>R
C. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z单质能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com