
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。[来
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)ΔH1=+156.6 kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH==CH2(g)+H2(g)的ΔH_______kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为________________;放电时,CO32—移向电池的________(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的二级电离,则H2CO3![]() HCO3—+H+的平衡常数K1=__________。(已知:10-5.60=2.5×10-6)
HCO3—+H+的平衡常数K1=__________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3)_____________c(CO32—)(填“>”、“=”或“<”),原因是___________________(用离子方程式和必要的文字说明)。
【答案】(1)+124.2
(2)C3H8+5O2==3CO2+4H2O 负
(3)4.2×10-7 mol·L-1
(4)> ;HCO3—+H2O![]() CO32—+H3O+(或HCO3—
CO32—+H3O+(或HCO3—![]() CO32—+H+),HCO3—+H2O
CO32—+H+),HCO3—+H2O![]() H2CO3+OH-,HCO3—的水解程度大于电离程度
H2CO3+OH-,HCO3—的水解程度大于电离程度
【解析】
试题分析:(1)根据根据盖斯定律,将两反应式相减得C3H8(g)==CH3CH=CH2(g)+H2(g)的ΔH=+124.2 kJ·mol-1。
(2)该燃料电池的电解质是熔融碳酸盐,电池反应方程式是C3H8+5O2===3CO2+4H2O ;放电时,阴离子向负极移动。
(3)根据平衡常数K1=c(H+)c(HCO3—)/ c(H2CO3),达到平衡时,溶液的pH=5.60,c(H+)=c(HCO3—)=2.5×10-6 mol·L-1,c(H2CO3)=1.5×10-5 mol·L-1,可求出K1=4.2×10-7。
(4)由NaHCO3溶液的pH>8得HCO3—的水解程度大于电离程度。


科目:高中化学 来源: 题型:
【题目】已知常温常压下,N≡N 键的键能是 946 kJ/mol、N-H 键的键能是391 kJ/mol、H-H 键的键能是 436 kJ/mol.现有甲、乙两个容积相同的定容密闭容器,在常温下: ①向密闭容器甲中通入1mol N2 和3mol H2,达到平衡时放出热量 Q1kJ. ②向密闭容器乙中通入0.5mol N2 和 1.5mol H2,达到平衡时放出热量 Q2 kJ.则下列关系式正确的是( )
A. 92>Ql>2Q2 B. 92=Q1<2Q2 C. Q1=2Q2=92 D. Q1=2Q2<92
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下表,下列说法错误的是( )

A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,平衡常数为1600
2Z,平衡常数为1600
C.其他条件不变时,增大压强可使平衡常数增大
D.改变温度可以改变该反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 化学反应的反应热与反应过程有密切的关系
B. 化学反应的反应热取决于反应体系的始态和终态
C. 盖斯定律只是一条简单的自然规律,其实际作用不大
D. 有的化学反应过程没有能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒定温度为T1℃时,在容积为10 L的密闭容器中充人1.0mol X和0.80 mol Y,发生反应:2X(g) + Y(g) ![]() 2Z(g),X的转化率随时间的变化关系如右图所示。
2Z(g),X的转化率随时间的变化关系如右图所示。
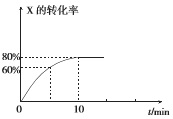
(1)第2 min时的反应速率v1(X)_________(填“大于”、“小于”或“等于”)第8 min时的反应速率可v2(X),原因是_________________。
(2)反应在0~10 min内Y的平均反应速率v(Y)=________mol.L-1.min-l。
(3)T1℃温度下反应的平衡常数K1为___________,若在第10 min后压缩容器容积,X的转化率_________(填“增大”、“减小”或“不变”,下同),平衡常数____________。
(4)若升高温度到T2℃( T2>T1),平衡时X的转化率减小,则该反应的△H______0(填 “大于”或“小于”)。
(5)不改变各物质起始量的情况下,无论如何改变条件,Y的转化率一定小于____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.物质发生化学变化都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.伴有能量变化的物质变化都是化学变化
D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 浓H2SO4具有氧化性,可用作SO2的干燥剂
B. H2O2能使蛋白所变性,可用作医疗的消毒剂
C. C2H4气体具有可燃性,可用作果实的催熟剂
D. Fe2O3水溶液显弱酸性,可用作H2S的脱除剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原子序数大于4的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,则:
①A和B周期数之差为________
②A和B的质子数之差为___________(用m、n表示)
③B和A的族序数之差为_______________(用含m、n的代数式表示)
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。
如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为______________;
当B在A的下一周期时,B的原子序数为______________;
如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为______________;
当B在A的下一周期时,B的原子序数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com