
【题目】根据能量变化示意图,下列说法正确的是

A. 拆开2molH2(g)和1molO2(g)中的化学键,共放出1368kJ能量
B. 1molH2和0.5molO2的能量之和比1molH2O(l)的能量大242kJ
C. 2H2O(g)=2H2(g)+O2(g) △H=484kJ/mol
D. 2H2(g)+O2(g)=2H2O(l) △H=572kJ/mol
【答案】C
【解析】A.拆化学键吸收能量;A项错误;B.根据图象数据分析计算,2molH2(g)和1molO2(g)反应生成2molH2O(l),共放出484+88=572kJ能量,则 1mol H2和0.5mol O2的能量之和比1molH2O(1)的能量大286kJ,B项错误;C.根据图象数据可知,2H2(g)+O2(g) =2H2O(g) △H=-484 kJ/mol,反应逆向进行,反应热的数值不变,符号相反,则2H2O(g)=2H2(g)+O2(g) △H=484 kJ/mol,C项正确;D.根据B项分析可知,2H2(g)+O2(g)=2H2O(1) △H=-572kJ/mol,D项错误。答案选C。


科目:高中化学 来源: 题型:
【题目】恒定温度为T1℃时,在容积为10 L的密闭容器中充人1.0mol X和0.80 mol Y,发生反应:2X(g) + Y(g) ![]() 2Z(g),X的转化率随时间的变化关系如右图所示。
2Z(g),X的转化率随时间的变化关系如右图所示。
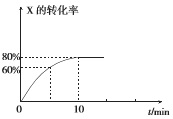
(1)第2 min时的反应速率v1(X)_________(填“大于”、“小于”或“等于”)第8 min时的反应速率可v2(X),原因是_________________。
(2)反应在0~10 min内Y的平均反应速率v(Y)=________mol.L-1.min-l。
(3)T1℃温度下反应的平衡常数K1为___________,若在第10 min后压缩容器容积,X的转化率_________(填“增大”、“减小”或“不变”,下同),平衡常数____________。
(4)若升高温度到T2℃( T2>T1),平衡时X的转化率减小,则该反应的△H______0(填 “大于”或“小于”)。
(5)不改变各物质起始量的情况下,无论如何改变条件,Y的转化率一定小于____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )

A. X与M形成的一个阴离子中含有29个电子
B. 气态氢化物沸点Y>R
C. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z单质能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,C与A同主族;A与B、D、E所形成的常见化合物在常温下均呈气态,在周期表中D与E左右相邻,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数与E的最外层电子数相同。
请回答下列问题:
(1)B在元素周期表的位置为第_____周期,第_____族。
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序为______(用离子符号表示)。
(3)A、B、E可组成一种化合物,其原子个数之比为4:1:1,该化合物的水溶液与C的最高价氧化物的水化物反应的离子方程式为____________________________________;
(4)B的一种氢化物分子中含有18个电子,其结构式为____________;C与D同主族短周期元素原子形成个数比为1:1的化合物,用电子式表示其化学键的形成过程为________________________。
(5)BE3在常温下是一种淡黄色的液体,遇水即发生水解可生成一种具有漂白性的物质和一种核外电子总数为10的气体,写出该反应的化学方程式___________________________;
(6)下列事实能证明D与E非金属性强弱的是_____________________(选填字母序号)。
A.常温下,D的单质呈固态,E的单质呈气态
B.E的氢化物的稳定性强于D的氢化物
C.E与D形成的化合物中,D呈正价
D.E的氢化物的沸点高于D的氢化物
(7)已知D、E两种元素形成的化合物H,H结构与过氧化氢相似,属于______________(填“离子”或“共价”)化合物。5.4 g的H中含有的共用电子对数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原子序数大于4的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,则:
①A和B周期数之差为________
②A和B的质子数之差为___________(用m、n表示)
③B和A的族序数之差为_______________(用含m、n的代数式表示)
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。
如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为______________;
当B在A的下一周期时,B的原子序数为______________;
如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为______________;
当B在A的下一周期时,B的原子序数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究元素周期律,甲根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的研究;乙根据置换反应的规律,利用下图装置完成O元素的非金属性比S强的研究。回答:
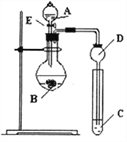
(1)图中A装置名称是______________。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3 溶液 ⑤SiO2
试剂A与C分别为_________(填序号);试管中发生反应的离子方程式为_______________.有同学认为此实验不能说明N、C、S的非金属性强弱,你认为原因是_________________
(3)乙同学设计的实验所用到试剂A为________;如果C试剂为硫化氢的水溶液,则试管中可以观察到的现象为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去括号内杂质的有关操作方法不正确的是( )
A. 淀粉溶液(葡萄糖):渗析
B. 乙醇(乙酸):加KOH溶液,分液
C. 甲醛溶液(甲酸):加NaOH溶液,蒸馏
D. 肥皂液(甘油):加食盐搅拌、盐析、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所含分子数由多到少的排列顺序是
A.标准状况下33.6L H2
B.物质的量为4mol的 H2
C.20℃,45gH2O
D.常温下,16gO2 与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素人工合成的部分反应流程如下:

(1)化合物G中含有的官能团名称为:__________、__________,E→F的反应类型为__________。
(2)D→E先后由加成和消去两步反应完成,加成后得到的中间产物的结构简式为__________。
(3)B→C的方程式为__________。(4)写出符合下列要求的H的一种同分异构体的结构简式__________。
①既能与NaHCO3反应放出气体,也能使FeCl3溶液显紫色;
②分子中有四种不同环境的氢原子。
(5)利用题中所给信息,试以苯甲醇( )和乙烯为原料(其他无机试剂任选),合成
)和乙烯为原料(其他无机试剂任选),合成 。__________________________
。__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com