
����Ŀ����֪A��B��C��D��E���ֶ���������Ԫ�ص�ԭ��������������A��Ԫ�����ڱ���ԭ�Ӱ뾶��С�ģ�C��Aͬ���壻A��B��D��E���γɵij����������ڳ����¾�����̬�������ڱ���D��E�������ڣ�B������������ˮ���������⻯�ﷴӦ�����Σ���B�ĺ˵������E��������������ͬ��
��ش��������⣺
(1)B��Ԫ�����ڱ���λ��Ϊ��_____���ڣ���_____�塣
(2)C��D��E����Ԫ���γɵļ����ӵİ뾶�ɴ�С��˳��Ϊ______(�����ӷ��ű�ʾ)��
(3)A��B��E�����һ�ֻ������ԭ�Ӹ���֮��Ϊ4:1:1,�û������ˮ��Һ��C������������ˮ���ﷴӦ�����ӷ���ʽΪ____________________________________��
(4)B��һ���⻯������к���18�����ӣ���ṹʽΪ____________��C��Dͬ���������Ԫ��ԭ���γɸ�����Ϊ1:1�Ļ�����õ���ʽ��ʾ�仯ѧ�����γɹ���Ϊ________________________��
(5)BE3�ڳ�������һ�ֵ���ɫ��Һ�壬��ˮ������ˮ�������һ�־���Ư���Ե����ʺ�һ�ֺ����������Ϊ10�����壬д���÷�Ӧ�Ļ�ѧ����ʽ___________________________��
(6)������ʵ��֤��D��E�ǽ�����ǿ������_____________________(ѡ����ĸ���)��
A�������£�D�ĵ��ʳʹ�̬��E�ĵ��ʳ���̬
B��E���⻯����ȶ���ǿ��D���⻯��
C��E��D�γɵĻ������У�D������
D��E���⻯��ķе����D���⻯��
(7)��֪D��E����Ԫ���γɵĻ�����H��H�ṹ������������ƣ�����______________(��������������������)�����5.4 g��H�к��еĹ��õ��Ӷ���ĿΪ________��
���𰸡� �� VA S2����Cl- ��Na�� NH4+ +OH�� ==NH3 +H2O (��һˮ�ϰ�) 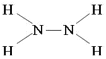
![]() NCl3+3H2O=3HClO+NH3�� BC ���� 0.12NA
NCl3+3H2O=3HClO+NH3�� BC ���� 0.12NA
����������֪A��B��C��D��E���ֶ���������Ԫ�ص�ԭ��������������A��Ԫ�����ڱ���ԭ�Ӱ뾶��С�ģ�AΪHԪ�أ�C��Aͬ���壻A��B��D��E���γɵij����������ڳ����¾�����̬����CΪNaԪ�أ�B������������ˮ���������⻯�ﷴӦ�����Σ�BΪNԪ�أ������ڱ���D��E�������ڣ���B�ĺ˵������E��������������ͬ����EΪClԪ�أ�DΪSԪ�ء�
(1)BΪNԪ�أ���Ԫ�����ڱ���λ�ڵڶ����ڵ�VA�壬�ʴ�Ϊ������VA��
(2)���Ӳ���Խ�࣬���Ӱ뾶Խ������ͬʱ���˵����Խ�����Ӱ뾶ԽС��C��D��E����Ԫ���γɵļ����ӵİ뾶�ɴ�С��˳��ΪS2����Cl- ��Na�����ʴ�Ϊ��S2����Cl- ��Na����
(3)A��B��E�����һ�ֻ������ԭ�Ӹ���֮��Ϊ4:1:1���û�����Ϊ�Ȼ�泥��Ȼ�淋�ˮ��Һ���������Ʒ�Ӧ�����ӷ���ʽΪNH4+ +OH�� ==NH3 +H2O���ʴ�Ϊ��NH4+ +OH�� ==NH3 +H2O��
(4)N��һ���⻯������к���18�����ӣ���ṹʽΪ ��C��Dͬ���������Ԫ��ԭ���γɸ�����Ϊ1:1�Ļ�����Ϊ�������⣬�õ���ʽ��ʾ�仯ѧ�����γɹ���Ϊ
��C��Dͬ���������Ԫ��ԭ���γɸ�����Ϊ1:1�Ļ�����Ϊ�������⣬�õ���ʽ��ʾ�仯ѧ�����γɹ���Ϊ![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��![]() ��
��
(5)NCl3�ڳ�������һ�ֵ���ɫ��Һ�壬��ˮ������ˮ�������һ�־���Ư���Ե����ʴ������һ�ֺ����������Ϊ10�����就�����÷�Ӧ�Ļ�ѧ����ʽΪNCl3+3H2O=3HClO+NH3�����ʴ�Ϊ��NCl3+3H2O=3HClO+NH3����
(6)A���ǽ�����ǿ�������ʵ�״̬�أ�����B��Ԫ�صķǽ�����Խǿ���⻯��Խ�ȶ���E���⻯����ȶ���ǿ��D���⻯���֤��D��E�ǽ�����ǿ����ȷ��C��E��D�γɵĻ������У�D������ ��˵��E�������ӵ�����ǿ����֤��D��E�ǽ�����ǿ����ȷ��D�����ʵķе���ǽ����Ե�ǿ���أ�����ѡBC��
(7)�����������ڹ��ۻ����H�ṹ������������ƣ����ڹ��ۻ����H�ķ���ʽΪS2Cl2��5.4 g��H�����ʵ���Ϊ![]() =0.04mol�����еĹ��õ��Ӷ���ĿΪ0.04mol ��
=0.04mol�����еĹ��õ��Ӷ���ĿΪ0.04mol ��![]() ��3��NA/mol=0.12NA���ʴ�Ϊ�����ۣ�0.12NA��
��3��NA/mol=0.12NA���ʴ�Ϊ�����ۣ�0.12NA��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ��Ϊ���ȷ�Ӧ�����з�Ӧ����С����
A. 2A(l) + B(l) = 2C (g) ��H1
B. 2A(g) + B(g) = 2C(g) ��H2
C. 2A (g) + B ( g ) = 2C(l) ��H3
D. 2A (l) + B(l)= 2C(l) ��H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij�ֹ��ԣ��ɽ�CO2��SO2��Ϊһ����������������У�Ҳ����ͬ������������� ��
A��CaCO3 B.SO3 C��CuO D��KMnO4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£���ͬ�����N2��CO2����������ֵΪ �����ʵ����ı�ֵ �� ԭ������֮��Ϊ �� ����֮��Ϊ �� �ܶ�֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ܱպ��������м���1.0 mol��L-1X��������Ӧ��2X(g) ![]() Y(g)+Z(g) ��H��0����Ӧ��8minʱ�ﵽƽ�⣻��14minʱ�ı���ϵ���¶ȣ� 16minʱ������ƽ�⡣X�����ʵ���Ũ�ȱ仯��ͼ��ʾ�������й�˵����ȷ����
Y(g)+Z(g) ��H��0����Ӧ��8minʱ�ﵽƽ�⣻��14minʱ�ı���ϵ���¶ȣ� 16minʱ������ƽ�⡣X�����ʵ���Ũ�ȱ仯��ͼ��ʾ�������й�˵����ȷ����
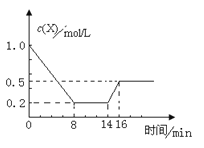
A��0��8min��Y��ʾ�÷�Ӧ����Ϊ0.1mol��L-1��min��1
B��8minʱ�ﵽƽ�⣬�÷�Ӧ��ƽ�ⳣ��ΪK= 0.5
C��14minʱ���ı�ķ�Ӧ���ǽ������¶�
D��16minʱ������Ӧ���ʱ�8minʱ������Ӧ���ʴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A�����������ﲻһ���Ǽ���������
B��HC1��H2S��NH3���ǵ����
C��ǿ��ǿ������ӻ�����
D��FeBr3��FeCl2��CuS������ֱ���û��Ϸ�Ӧ�Ʊ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯ʾ��ͼ������˵����ȷ����

A. ��2molH2(g)��1molO2(g)�еĻ�ѧ�������ų�1368kJ����
B. 1molH2��0.5molO2������֮�ͱ�1molH2O(l)��������242kJ
C. 2H2O(g)=2H2(g)+O2(g) ��H=484kJ/mol
D. 2H2(g)+O2(g)=2H2O(l) ��H=572kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL 0.2mol/L H2A��Һ�еμ�0.2mol/L NaOH��Һ���й��������ʵ����仯��ͼ�����Т����H2A�������HA-�������A2-����ʾ������ͼʾ�жϣ�����˵����ȷ���ǣ� ��
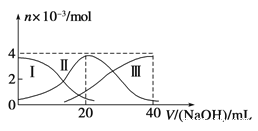
A����V��NaOH��=20 mLʱ����Һ������Ũ�ȴ�С��ϵ��
c��Na+����c��HA-����c��A2-����c��H+����c��OH-��
B����Ũ�ȵ�NaOH��Һ��H2A��Һ��2��1��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮС
C��NaHA��Һ�У�c��OH-��+c��A2-��=c��H+��+c��H2A��
D������������20mLNaOH��Һ��������Һ���ټ���ˮ�Ĺ����У�pH���ܼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������ԭ�Ӷ����������Ϊ8���ӽṹ����
A. BeCl2 B. NH3 C. PCl5 D. N2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com