
【题目】为应对全球气候变暖,科学家在综合利用 CO2 方面取得了不少研究成果。如用 CO2 合成重要化工原料 CH3OH,同时生成 CO,反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0),
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)-Q2kJ(Q2>0)。
研究催化剂等外界条件对上述反应的影响,结果如图 1、图 2
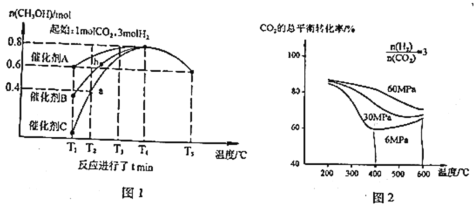
完成下列填空:
(1)一定是碳12的同位素原子是_____(选填“A”、“B”、“C”、“D”)
A.质子数为6,中子数为8 B.质子数为8,中子数为12
C.质子数为12,中子数为6 D.质子数为12,中子数为8
(2)分析图1:催化效果最佳的是催化剂_____(选填“A”、“B”、“C”)。若密闭容器体积为2L,则a点测得CH3OH的平均生成速率为_____mol·L-1·min-1。b点反应_____(填“达到”或“未达到”)平衡状态,理由是:_____
(3)分析图2:相同温度下,增大原料气压强,反应Ⅰ平衡常数_____(选填“增大”、“减小”、“不变”、“无法判断”);当压强为6Mpa、温度在400~600℃时,CO2的总体平衡转化率随温度升高而增大的原因是___________________________________
(4)若生成的CH3OH和CO物质的量之比为4:1,则消耗相同条件下的CO2和H2体积比是_____
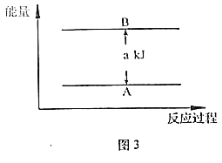
(5)若有88gCO2发生反应Ⅰ,并放出akJ热量,则图3中A为_____,B为_____
【答案】A A ![]() 未达到 此温度催化剂A得到的甲醇更多,即b若时间增加,在此条件下可以得到更多的生成物(合理即可) 不变 反应Ⅱ中
未达到 此温度催化剂A得到的甲醇更多,即b若时间增加,在此条件下可以得到更多的生成物(合理即可) 不变 反应Ⅱ中![]() 增大的平衡转化率大于反应Ⅰ中
增大的平衡转化率大于反应Ⅰ中![]() 减小的平衡转化率
减小的平衡转化率 ![]()
![]()
![]()
【解析】
(1)质子数相同而中子数不同的同一元素的不同原子互为同位素;
(2)相同温度下甲醇的产量越高,催化剂的催化效果越好。根据v=![]() =
=![]() 计算;反应达到平衡状态时,各组分的含量保持不变,b点对应温度下使用催化剂A时甲醇物质的量大于b点,b点之后随时间的增加,在此条件下可以得到更多的生成物,据此分析解答;
计算;反应达到平衡状态时,各组分的含量保持不变,b点对应温度下使用催化剂A时甲醇物质的量大于b点,b点之后随时间的增加,在此条件下可以得到更多的生成物,据此分析解答;
(3)平衡常数只与温度有关,温度不变,平衡常数不变;根据反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0)为气体分子数目减小的放热反应,反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)-Q2kJ(Q2>0)为气体分子数不变的吸热反应,根据外界条件对反应平衡移动的影响分析;
(4)结合反应Ⅰ和反应Ⅱ,根据“三段式”分析解答;
(5)反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0)为放热反应,反应物的总能量大于生成物的总能量,结合参与反应的CO2的量计算分析解答。
(1)质子数相同而中子数不同的同一元素的不同原子互为同位素,碳原子的质子数为6,碳12的质子数为6、中子数为6,与碳12互为同位素原子质子数也应为6、中子数不为6,符合题意的只有A,答案选A;
(2)相同温度下甲醇的产量越高,催化剂的催化效果越好,如图所示,T1温度时,在催化剂A的作用下甲醇的产量最高,则A的催化作用最好;根据图示,经过tmin,a点测得生成CH3OH的物质的量为0.4mol,根据v=![]() =
=![]() , a点时CH3OH的平均生成速率为
, a点时CH3OH的平均生成速率为![]() =
=![]() mol·L-1·min-1;反应达到平衡状态时,各组分的含量保持不变,根据图示,b点对应温度下使用催化剂A时甲醇物质的量大于b点,说明b点之后随时间的增加,在此条件下可以得到更多的生成物,说明b点未达到平衡状态;
mol·L-1·min-1;反应达到平衡状态时,各组分的含量保持不变,根据图示,b点对应温度下使用催化剂A时甲醇物质的量大于b点,说明b点之后随时间的增加,在此条件下可以得到更多的生成物,说明b点未达到平衡状态;
(3)平衡常数只与温度有关,温度不变,平衡常数K不变;反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0)为气体分子数目减小的放热反应,反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)-Q2kJ(Q2>0)为气体分子数不变的吸热反应,6Mpa、温度在400~600℃时,升高温度,反应Ⅰ平衡逆向移动,CO2的转化率减小,反应Ⅱ的平衡正向移动,CO2的转化率增大,导致CO2的总体平衡转化率随温度升高而增大的原因可能是反应Ⅱ中![]() 增大的平衡转化率大于反应Ⅰ中
增大的平衡转化率大于反应Ⅰ中![]() 减小的平衡转化率;
减小的平衡转化率;
(4)若生成的CH3OH和CO物质的量之比为4:1,设CH3OH和CO物质的量分别为4mol和1mol,则:

反应过程中一共消耗CO25mol,消耗氢气13mol,同条件下,物质的量之比等于体积之比,则消耗相同条件下的CO2和H2体积比是5:13;
(5)反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0)为气体分子数目减小的放热反应,即反应物的总能量大于生成物的总能量,若有88gCO2发生反应Ⅰ,并放出akJ热量,即参加反应的二氧化碳的物质的量=![]() =2mol,结合图示,则A为2CH3OH(g)+2H2O(g),B为2CO2(g)+6H2(g)。
=2mol,结合图示,则A为2CH3OH(g)+2H2O(g),B为2CO2(g)+6H2(g)。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】已知Fe3O4是一种复杂的化合物,其化学式可改写为FeO·Fe2O3。对于Fe与水蒸气反应后的黑色物质,有三个学习小组提出了三种不同的猜想,以下是小组同学进行的实验猜想与探究,请你根据小组的思路与提示完成相关空白。
实验之前查阅资料得知Fe3+的盐溶液遇到KSCN溶液时,溶液变成红色,而Fe2+遇KSCN溶液无明显变化。
[猜想]甲组:黑色物质是FeO
乙组:黑色物质是Fe3O4
丙组:____________;
[实验探究]
(1)丙组认为一种简单定性的方法即可判断甲组的正误:取生成的黑色物质少许于烧杯中,加稀盐酸使其完全溶解,再加________溶液以检验Fe3+,观察到溶液有无出现________现象即可判断。
(2)乙组认为可通过定量测定来确定生成的黑色物质的组成,以验证该组猜想正确。取生成的黑色物质2.32 g溶解于适量稀盐酸后,加入新制氯水,加入氯水后反应的离子方程式为__________,再加入足量NaOH溶液后,过滤、洗涤、烘干、灼烧、称量,若称得固体质量为________,即可判断乙组同学猜想正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M 在周期表中的位置关系如右图,对这些元素形成的单质或化合物推测正确的是( )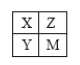
A.若Z元素形成的单质是Z2,则M元素形成的单质也一定是M2
B.若HnX常温下是气体,则HmZ 常温下也是气体
C.若有碱M(OH)n,则也一定有碱Y(OH)m
D.若Y有最高价含氧酸HnYOm,则X也一定有最高价含氧酸HnXOm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有未知浓度的盐酸25 mL,能跟20 mL某浓度的氢氧化钠溶液完全反应。若先用0.1 g 碳酸钙与25 mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4 mL才能中和。求盐酸和氢氧化钠溶液中溶质的物质的量浓度分别是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b为等质量的电极,电解槽中盛有1 L 1.0 mol·L-1CuSO4溶液,电解前后溶液体积变化忽略不计,下列有关叙述正确的是
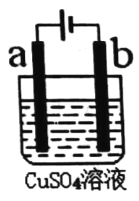
A.电子的流向:负极→b→a→正极
B.若为电解精炼铜装置,则a为粗铜;若为电镀铜装置,则b为纯铜
C.电镀铜或电解精炼铜,溶液中Cu2+浓度均不变
D.若为电镀铜,当电路中通过的电子为0.2mol时,两极的质量相差12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制1 molL﹣1的NaOH溶液450 mL。请回答下列问题:
(1)计算:需要称取NaOH固体__g。
(2)配制时,必须使用的仪器有托盘天平(带砝码)、药匙、烧杯、玻璃棒、量简,还缺少的仪器是__、__。(填仪器名称)
(3)在使用容量瓶前必须进行的一步操作是__。
(4)实验两次用到玻璃棒,其作用分别是:先用于__、后用于__。
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是__(填字母)。
A.容量瓶实验前用蒸馏水洗干净,但未烘干
B.天平砝码生锈
C.配制过程中遗漏了洗涤步骤
D.未冷却到室温就注入容量瓶
E.加蒸馏水时不慎超过了刻度线
F.定容观察液面时俯视
(6)若实验过程中出现(5)中D这种情况你将如何处理?__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn,发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。下列判断正确的是( )
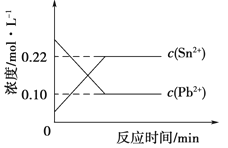
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应正反应是吸热反应
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)某蓄电池的正负极标志难以辨别,请设计实验方案,将蓄电池的正负极辨别出来____________________。
(2)解释下列化学反应的反应速率变化关系曲线
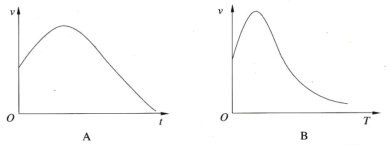
①将除去氧化膜的镁条投入盛有稀盐酸的试管中,产生氢气的速率随时间的变化关系如图A所示,试解释原因:_________________________________________________________。
②过氧化氢在酶的催化作用下的分解速率随温度的变化关系如图B所示,试解释原因:______________________。
(3)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
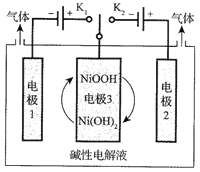
①制H2时,连接_______________。
②改变开关连接方式,可得O2,电极反应式为___________________________。
③结合①和②中电极3的电极反应式,说明电极3的作用:______________________________。
(4)甲醇燃料电池DMFC可作电脑、汽车的能量来源。在实验室完成一个实验,用DMFC电解NaClO3溶液可制取NaClO4溶液,装置如图所示(其中DMFC以KOH作电解质)。
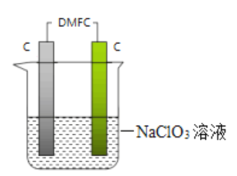
①写出电源负极电极反应式:______________________________。
②写出电解的总反应化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于氧化还原反应的是
A.H2+CuO![]() H2O+Cu
H2O+Cu
B.Cl2+2NaOH=NaCl+NaClO+H2O
C.2Na2O2+2H2O=4NaOH+O2↑
D.Ca(OH)2+2HCl=CaCl2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com