
【题目】请直接用计算结果填空:
(1)标准状况下,测定1.32g某气体X的体积为0.672L,则X的摩尔质量为__。
(2)已知5.1g镁铝合金与100mL某浓度的盐酸恰好完全反应,得到5.6L氢气(标准状况下)。则:①生成的H2分子的数目是__NA。
②该合金中镁和铝的物质的量之比为__。
③上述盐酸的物质的量浓度为__。
【答案】44g/mol 0.25或![]() 1:1 5mol/L
1:1 5mol/L
【解析】
(1)标准状况下,根据n=![]() ,计算 X气体的物质的量根据n=
,计算 X气体的物质的量根据n=![]() ,则M=
,则M=![]() ,计算X的摩尔质量;
,计算X的摩尔质量;
(2)①根据n=![]() =
=![]() ,计算生成的H2分子的数目;
,计算生成的H2分子的数目;
②设该合金中镁和铝的物质的量分别为x、y,根据反应:

根据物质的量关系,列关系式计算该合金中镁和铝的物质的量之比;
③根据上述反应,计算消耗盐酸的物质的量,再根据c=![]() ,计算盐酸的物质的量浓度。
,计算盐酸的物质的量浓度。
(1)标准状况下,根据n=![]() ,气体X的体积为0.672L,则X气体的物质的量=
,气体X的体积为0.672L,则X气体的物质的量=![]() =0.03mol,根据n=
=0.03mol,根据n=![]() ,则M=
,则M=![]() ,则X的摩尔质量=
,则X的摩尔质量=![]() =44g/mol;
=44g/mol;
(2)①根据n=![]() =
=![]() ,则生成的H2分子的数目是
,则生成的H2分子的数目是![]() =
=![]() =0.25 NA或
=0.25 NA或![]() NA;
NA;
②设该合金中镁和铝的物质的量分别为x、y,根据反应:

则24x+27y=5.1g,![]() y+x=
y+x=![]() ,解得x=0.1mol,y=0.1mol,则该合金中镁和铝的物质的量之比=0.1mol:0.1mol=1:1;
,解得x=0.1mol,y=0.1mol,则该合金中镁和铝的物质的量之比=0.1mol:0.1mol=1:1;
③根据上述反应,消耗盐酸的物质的量=2x+3y=0.2+0.3=0.5mol,盐酸的物质的量浓度=![]() =5mol/L。
=5mol/L。


科目:高中化学 来源: 题型:
【题目】四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,![]() 的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是![]() 的氢化物
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素![]() 形成的离子
形成的离子
D. 常温下,![]() 三种元素形成的化合物的水溶液的
三种元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是( )
目的 | 操作 | |
A | 配制480mL0.1mol/LCuSO4溶液 | 称取8.0g无水硫酸铜放在烧杯中,加入480mL的蒸馏水,用玻璃棒搅拌。 |
B | 除去氯化钠固体中少量的碳酸钙 | 加水稀盐酸、然后加热蒸干。 |
C | 提取碘水中的碘 | 用量筒量取一定量的碘水,倒入分液漏斗,注入四氯化碳,振荡、静置后分液。 |
D | 除去N2气体中的少量O2 | 点燃,然后将混合气体通入澄清石灰水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。

(1)D中的实验现象是_____________,C、E中溶液都褪色,分别体现SO2________、_______性质。
(2)请在方框中画出收集SO2以及尾气处理装置(标相关试剂)。___________
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀 不溶解,你认为留下的沉淀物是__________,形成该沉淀的反应方程式有:_________________________________________________________________________________
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及 时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑 浊。研究小组改进A装置(如图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是_____________

A.CO2 B.NH3 C.O3 D.N2 E.NO2
(4)SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气, 缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:
① 检验洗涤已经干净的实验操作是_________________________________________________。
② 试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)1.7gNH3与标况下_________LH2S中的氢原子数相同
(2)在标准状况((___________)℃ 、_____________KPa)下,CO和CO2的混合气体共4.48L,质量为7.2g。则两种气体的物质的量之和为____________mol,该混合气体的平均相对分子质量为___________,其中CO2为___________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:

下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )

A.反应的化学方程式为2N![]() M
M
B.t2时,正逆反应速率相等达到平衡状态
C.t1时,M的浓度是N浓度的2倍
D.t3时,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )
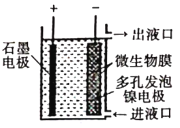
A. 若加人的是![]() 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性
B. 镍电极上的电极反应式为:![]()
C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成![]() 气体,理论上可除去
气体,理论上可除去![]() mol
mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校同学设计下列实验,探究CaS脱除烟气中的SO2并回收S。实验步骤如下:
步骤1.称取一定量的CaS放入三口烧瓶中并加入甲醇作溶剂(如下图所示)。
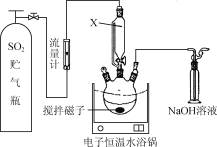
步骤2.向CaS的甲醇悬浊液中缓缓通入一定量的SO2。
步骤3.过滤,得滤液和滤渣。
步骤4.从滤液中回收甲醇(沸点为64.7 ℃),所得残渣与步骤3的滤渣合并。
步骤5.用CS2从滤渣中萃取回收单质S。
(1) 图中用仪器X代替普通分液漏斗的突出优点是________________。
(2) 三口烧瓶中生成硫和亚硫酸钙的化学方程式为________________,三口烧瓶中最后残留固体中含一定量的CaSO4,其原因是________________。
(3) 步骤4“回收甲醇”需进行的操作方法是________________。
(4) 步骤5为使滤渣中S尽可能被萃取,可采取的操作方案是________________。
(5) 请设计从上述回收的S和得到的含Na2SO3吸收液制备Na2S2O3·5H2O的实验方案:
称取稍过量硫粉放入烧杯中,__________________________________________,用滤纸吸干。
已知:① 在液体沸腾状态下,可发生反应Na2SO3+S+5H2O![]() Na2S2O3·5H2O。
Na2S2O3·5H2O。
②硫不溶于Na2SO3溶液,微溶于乙醇。
③为获得纯净产品,需要进行脱色处理。
④须使用的试剂:S、Na2SO3吸收液、乙醇、活性炭。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com