
【题目】碳热还原法广泛用于合金及材料的制备。回答下列问题
(1) 一种制备氮氧化铝的反应原理为23Al2O3+ 15C+5N2=2Al23O27N5+15CO,产物Al23O27N5 中氮的化合价为_____,该反应中每生成 l mol Al23O27N5转移的电子数为_______________ 。
(2) 真空碳热冶铝法包含很多反应.其中的三个反应如下:
Al2O3 (s) +3C(s)=Al2OC(s) +2CO(g) △H1
2Al2OC(s)+3C(s)=Al4C3(s)+2CO(g) △H2
2Al2O3(s) +9C(s)= Al4C3(s)+6CO(g) △H3
①△H3=________ ( 用△H1、△H2表示).
②Al4C3可与足量盐酸反应制备简单的烃。该反应的化学方程式为____________。
(3)下列是碳热还原制锰合金的三个反应 ,CO与CO2平衡分压比的自然对数(![]() ) 与温度的关系如图所示(已知Kp 是用平衡分压代替浓度计算所得的平衡常数,分压=总压 × 气体的物质的量分数)。
) 与温度的关系如图所示(已知Kp 是用平衡分压代替浓度计算所得的平衡常数,分压=总压 × 气体的物质的量分数)。

I. Mn3C(s)+4CO2(g) 3MnO(s)+ 5CO(g) Kp(I)
II. Mn(s) +CO2(g) MnO(s) +CO(g) Kp (II)
III. Mn3C(s)+CO2(g) 3Mn(s) +2CO(g) Kp(III)
①△H>O的 反应是_________ (填“I ”“II” 或“III”)。
②1200K时在 一体积为 2L 的恒容密闭容器中有17.7gMn3C( s)和0.4molCO2 ,只发生反应I,5min后达到平衡,此时CO的浓度为0.125mol/L,则0~5 min内 v(CO2)=_______。
③在一体积可变的密闭容器中加入一定量的Mn(s )并充入一定量的CO2(g) .只发生反应
II,下列能说明反应II 达到平衡状态的是________ (填标号)。
A. 容器的体积不再改变
B.固体的质量不再改变
C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.l molCO2, 若只发生反应III. 则在A点反应达到平衡时,容器的总压为akPa, CO2的转化率为______; A点对应温度下的Kp(III) =______。
【答案】-3 9.03×1024(或15NA) 2△H1 +△H2 Al4C3+12HCl=4AlCl3+3CH4↑ III 0.02molL-1min-1 BC 33.3% 0.5akPa
【解析】
(1)反应23Al2O3+15C+5N2=2Al23O27N5+15CO中,产物Al23O27N5中氮的化合价为-3价,该反应中每生成1mol Al23O27N5,转移的电子数为5×3NA =15 NA,故答案为:-3;9.03×1024(或15NA);
(2)已知Ⅰ、Al2O3(s)+3C(s)=Al2OC(s)+2CO(g) ΔH1
Ⅱ、2Al2OC(s)+3C(s)=Al4C3(s)+2CO(g) ΔH2
Ⅲ2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) ΔH3
①根据盖斯定律,由Ⅰ×2+Ⅱ得反应Ⅲ2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) ΔH3= 2ΔH1+ΔH2,故答案为:2△H1 +△H2;
②Al4C3可与足量盐酸反应制备一种最简单的烃CH4,根据质量守恒配平可得反应的化学方程式为Al4C3+12HC1=4AlCl3+3CH4↑,故答案为:Al4C3+12HC1=4AlCl3+3CH4↑;
(3)①由图中信息可知,反应Ⅲ升高温度,lnK增大,则K增大,平衡正向移动,正反应为吸热反应,ΔH>0,故答案为:Ⅲ;
②0~5min内v(CO2)=![]() v(CO)=
v(CO)=![]() ×
×![]() mol·L-1·min-1,故答案为:0.02molL-1min-1;
mol·L-1·min-1,故答案为:0.02molL-1min-1;
③反应Ⅱ.Mn(s)+CO2(g)![]() MnO(s)+CO(g)为气体体积不变的放热反应,根据“变量不变达平衡”进行判断;
MnO(s)+CO(g)为气体体积不变的放热反应,根据“变量不变达平衡”进行判断;
A.反应为气体不变的反应,反应过程容器的体积不是变量,不能作为平衡状态的判断依据,选项A不选;
B.反应是一个固体质量增大的反应,固体的质量为变量,当固体的质量不再改变说明达到平衡状态,选项B选;
C.反应是一个气体质量减小的反应,气体的总质量为变量,当不再改变说明达平衡状态,选项C选。
故答案为:BC;
④向恒容密闭容器中加入Mn3C并充入0.1molCO,若只发生反应Ⅲ,则在A点反应达到平衡,ln![]() ,则
,则![]() ,当容器的总压为akPa时,CO的转化率为
,当容器的总压为akPa时,CO的转化率为![]() ,A点对应温度下的Kp(Ⅲ)=
,A点对应温度下的Kp(Ⅲ)=![]() 0.5akPa,故答案为:33.3%;0.5akPa。
0.5akPa,故答案为:33.3%;0.5akPa。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】对反应:aA(g)+bB(g)![]() cC(g)+dD(g) ΔH,反应特点与对应的图象的说法中不正确的是
cC(g)+dD(g) ΔH,反应特点与对应的图象的说法中不正确的是
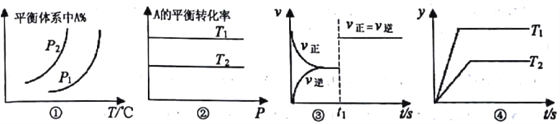
A. 图①中,若P1>P2,则该反应在较低温度下有利于自发进行
B. 图②中,若T2>T1,则△H<0 且a+b=c+d
C. 图③中t1时刻改变的条件一定是使用了催化剂
D. 图④中,若△H<0,则纵坐标不可能表示的是反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L1的NaOH溶液分别滴定均为20.00mL0.100mol·L1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
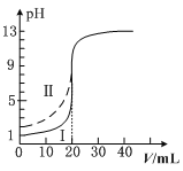
A.Ⅰ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D.V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.l mol/ L RCOOH溶液的pH, 溶液中 RCOOH、RCOO- 的微粒分布分数![]() 也随之改变,甲酸( HCOOH) 与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示.
也随之改变,甲酸( HCOOH) 与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示.

下列说法正确的是
A.丙酸的酸性比甲酸强
B.若0.1 mol/甲酸溶液的pH=2.33.则0.0lmol/L甲酸溶液的pH=3.33
C.将0.1mol/L的HCOOH溶液与0. 1 mol/L的HCOONa溶液等体积混合,所得溶液中:c( Na+ ) >c( H COO H ) >c( H COO- ) >c( OH-) >c ( H + )
D.CH3CH2COOHCH3CH2COO- +H+ lgK=-4 .88
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。在850℃时,K=1。
CO2(g)+H2(g) △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K__________1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向_____________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是_______________。
Ⅱ.在一固定容积的密闭容器中,保持一定温度,在一定条件下发生以下反应:2A(g)+B(g)![]() 3C(g),已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
3C(g),已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
(3)达到平衡时,C在反应混合气体中的体积分数是___(用含a的代数式表示)。
(4)在相同的实验条件下,若在同一容器中改为加入2 mol A和4 mol B,达到平衡后,C的物质的量为___mol(用含a的代数式表示)。此时C在反应混合气体中的体积分数与原平衡相比___(填“增大”“减小”或“不变”)。
(5)在相同实验条件下,若在同一容器中改为加入2 mol A和5 mol B,若要求平衡后C在反应混合气体中的体积分数仍与原平衡相同,则还应加入___mol C。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
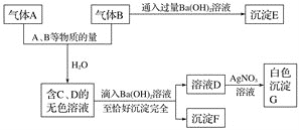
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
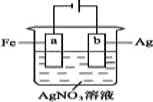

①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A. ①③B. ③④C. ①②④D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,组成单质A的元素有可变化合价。它们之间存在如下图所示的转化关系。由此推断:

(1)甲的化学式为________________,丙的化学式为________________。
(2)写出甲和D反应的化学方程式:_________________________________________。
(3)为检验化合物甲中元素的化合价,需要用到的药品有________(填字母)。
A.稀硫酸 B.盐酸
C.硫氰化钾溶液 D.高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题。
(Ⅰ)下列一组有水参与的反应
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
⑤2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是_____________(填编号)。
(2)在这些氧化还原反应中,水既作氧化剂,又作还原剂是___________(填编号),水既不作氧化剂,又不作还原剂是__________(填编号)。
(3)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?___________(填“是”或“不是”),若是,这个反应的氧化剂和还原剂的质量比是________;
(Ⅱ)写出下列反应的离子方程式
①铜片与稀硝酸的反应_____________________________________;
②往氯化铝溶液中加入过量的NaOH溶液______________________;
(Ⅲ)写出下列反应的化学方程式
①二氧化硫发生催化氧化反应_________________________________;
②制漂白液的反应____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com