
【题目】下列物质既能发生消去反应,又能发生水解反应的是 ( )
A.一氯甲烷 B. 1—溴—2—甲基丙烷
C.1—氯—2,2—二甲基丙烷 D.3—氯—2,2,4,4—四甲基戊烷
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C. 阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
A.分子式为C11H10
B.—氯代物有5种(不考虑立体异构)
C.不能形成高分子化合物
D.1mol该化合物最多能与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Z是一种常见的工业原料,实验室制备Z的化学方程式如下图所示。下列说法正确的是( )
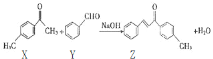
A.1molZ最多能与7molH2反应
B.Z分子中的所有原子一定共平面
C.可以用酸性KMnO4溶液鉴别X和Y
D.X的同分异构体中含有苯环和醛基的结构有14种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同元素的原子在分子内吸引电子的能力大小可用一数值x来表示,若x越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。下面是某些短周期元素的x值:

(1)通过分析x值的变化规律,确定N、Mg的x值范围: ____<x(N)<_____;_____<x(Mg)<_____。
(2)推测x值与原子半径的关系是_______________________________。
(3)某有机物结构式为C6H5SONH2,在S—N中,你认为共用电子对偏向谁?__________(写原子名称)。
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键的类型是____________。
(5)预测元素周期表中,x值最小的元素位置____________________(放射性元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列说法正确的是( )
A.0.1 mol·L-1 (NH4)2SO4溶液中c(![]() )<c(
)<c(![]() )
)
B.0.02 mol·L-1氨水和0.01 mol·L-1氨水中的c(OH-)之比是2∶1
C.向醋酸钠溶液中加入醋酸使溶液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
D.向0.1 mol·L-1 NaNO3溶液中滴加盐酸使溶液的pH=5,此时混合液中c(Na+)=c(![]() )(不考虑酸的挥发与分解)
)(不考虑酸的挥发与分解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72—还原为Cr3+。该反应的离子反应方程式为___________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:
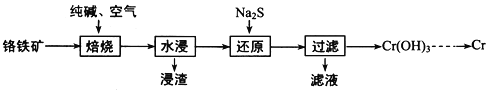
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是__________________________ 。
②“水浸”要获得浸出液的操作是_________________________________。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为___。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是 _______。
(3)已知 Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5molL-1可认为完全沉淀)则Cr(OH)3的溶度积常数 Ksp=_______________。
(4)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() + H2O)。
+ H2O)。
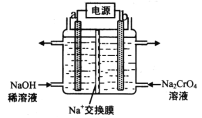
①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为_________________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 _______________mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的2L密闭容器,进行反应2X(g)+Y(g) ![]() 2Z(g),若起始时X、Y、Z物质的量分别为n1、n2、n3(均不为零)。达平衡时,X、Y、Z浓度分别为0.2mol/L、0.1 mol /L和0.08 mol/L,则下列判断合理的是( )
2Z(g),若起始时X、Y、Z物质的量分别为n1、n2、n3(均不为零)。达平衡时,X、Y、Z浓度分别为0.2mol/L、0.1 mol /L和0.08 mol/L,则下列判断合理的是( )
A. X和Y的转化率不一定相等
B. n1、n2=2:1
C. 平衡时,Y和Z的生成速率之比为2:1
D. n1的取值范围为0<n1<0.28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向50 mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下图所示。下列说法正确的是
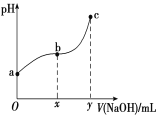
A. 若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=![]()
B. 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C. b~c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
D. 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com