
【题目】25 ℃时,下列说法正确的是( )
A.0.1 mol·L-1 (NH4)2SO4溶液中c(![]() )<c(
)<c(![]() )
)
B.0.02 mol·L-1氨水和0.01 mol·L-1氨水中的c(OH-)之比是2∶1
C.向醋酸钠溶液中加入醋酸使溶液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
D.向0.1 mol·L-1 NaNO3溶液中滴加盐酸使溶液的pH=5,此时混合液中c(Na+)=c(![]() )(不考虑酸的挥发与分解)
)(不考虑酸的挥发与分解)
【答案】D
【解析】
A. NH4+虽然会发生水解,但其水解程度非常微弱,因此(NH4)2SO4溶液中c(NH4+)>c(SO42),故A错误;
B. 相同条件下,弱电解质的浓度越小,其电离程度越大,因此0.02 mol·L-1氨水和0.01 mol·L-1氨水中的c(OH-)之比小于2∶1,故B错误;
C. 依据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),混合后溶液的pH=7,即c(H+)=c(OH-),可推出c(Na+)=c(CH3COO-),故C错误;
D. NaNO3是强酸强碱盐,Na+和NO3均不发生水解,NaNO3溶液也不与盐酸发生反应,根据物料守恒可得c(Na+)=c(NO3),故D正确。
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体![]() 的一种方案如下:
的一种方案如下:

下列说法不正确的是![]()
A.滤渣A的主要成分是![]()
B.“合成”反应要控制温,温度过高,产率会降低
C.“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等
D.相同条件下,![]() 净水能力比
净水能力比![]() 强
强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是( )

A.曲线I表示MnS的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点
C.常温下,反应MnS(s)+Fe2+(aq)![]() FeS(s)+Mn2+(aq)的平衡常数K≈4×104
FeS(s)+Mn2+(aq)的平衡常数K≈4×104
D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿工线向a点方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。请回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+![]() O2(g)=CO(g)ΔH1=-110.35kJ·mol-1
O2(g)=CO(g)ΔH1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l)ΔH2=-571.6kJ·mol-1
H2O(l)=H2O(g)ΔH3=+44.0kJ·mol-1
①则反应C(s)+H2O(g)![]() CO(g)+H2(g) ΔH4=__________。
CO(g)+H2(g) ΔH4=__________。
②某实验小组在实验室模拟反应C(s)+H2O(g)CO(g)+H2(g),其平衡常数表达式为K=_______。一定温度下,在2L盛有足量炭粉的恒容密闭容器(固体所占体积忽略不计)中通入0.8molH2O,6min时生成0.7gH2,则6min内以CO表示的平均反应速率为________(保留3位有效数字)。
(2)燃料气(流速为1800mL·min-1;体积分数为50%H2,0.98%CO,1.64%O2,47.38%N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。
①160℃、CuO/CeO2作催化剂时,CO优先氧化的化学方程式为__________。
②CeO2可由草酸铈[Ce2(C2O4)3]隔绝空气灼烧制得,同时生成两种气体,则发生反应的化学方程式为____________。
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
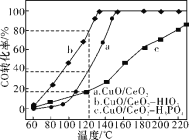
加入________(填酸的化学式)的CuO/CeO2催化剂催化性能最好。温度为120℃,催化剂为CuO/CeO2HIO3时,反应0.5h后CO的体积为______mL。
(3)LiOH是制备锂离子电池正极材料的重要原料,采用惰性电极电解制备LiOH的装置如下图所示。
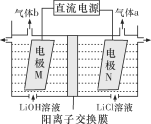
①通电后,Li+通过阳离子交换膜向________(填“M”或“N”)极区迁移。
②电极N产生的气体a通入淀粉-KI溶液,溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出电极N的电极反应式:___________;蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既能发生消去反应,又能发生水解反应的是 ( )
A.一氯甲烷 B. 1—溴—2—甲基丙烷
C.1—氯—2,2—二甲基丙烷 D.3—氯—2,2,4,4—四甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2是一种重要的光催化剂。以钛酸酯Ti(OR)4为原料制备纳米TiO2的步骤如下:
①组装装置如下图所示,保持温度约为65℃,先将30mL钛酸四丁酯[Ti(OC4H9)4]加入盛有无水乙醇的三颈烧瓶,再加入3mL乙酰丙酮,充分搅拌;
②将含水20%的乙醇溶液缓慢滴入三颈烧瓶中,得到二氧化钛溶胶;
③将二氧化钛溶胶干燥得到二氧化钛凝胶,灼烧凝胶得到纳米TiO2。
已知,钛酸四丁酯能溶于除酮类物质以外的大部分有机溶剂,遇水剧烈水解;Ti(OH)4不稳定,易脱水生成TiO2,回答下列问题:
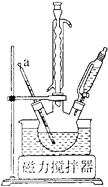
(1)仪器a的名称是_______,冷凝管的作用是________。
(2)加入的乙酰丙酮可以减慢水解反应的速率,其原理可能是________(填标号)。
a.增加反应的焓变 b.增大反应的活化能
c.减小反应的焓变 d.降低反应的活化能
制备过程中,减慢水解反应速率的措施还有________。
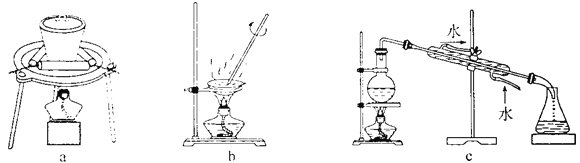
(3)步骤②中制备二氧化钛溶胶的化学方程式为________。下图所示实验装置中,可用于灼烧二氧化钛凝胶的是________(填标号)。
(4)测定样品中TiO2纯度的方法是:精确称取0.2000 g样品放入锥形瓶中,加入硫酸和硫酸铵的混合溶液,加强热使其溶解。冷却后,加入一定量稀盐酸得到含TiO2+的溶液。加入金属铝,将TiO2+全部转化为Ti3+。待过量的金属铝完全溶解并冷却后,加入指示剂,用0.1000 mol·L-lNH4Fe(SO4)2溶液滴定至终点。重复操作2次,消耗0.1000 mol·L-1 NH4Fe(SO4)2溶液的平均值为20.00 mL(已知:Ti3+ +Fe3++H2O=TiO2+ +Fe2+ +2H+)。
①加入金属铝的作用除了还原TiO2+外,另一个作用是________________。
②滴定时所用的指示剂为____________(填标号)
a.酚酞溶液 b. KSCN溶液 c. KMnO4溶液 d.淀粉溶液
③样品中TiO2的质量分数为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.打开汽水瓶.有气泡从溶液中冒出
B.H2、I2、HI混合气体加压后颜色变深
C.实验室中常用排饱和食盐水的方法收集氯气
D.合成氨工业采用高压条件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ti及其化合物在航天工业上有重要的应用,回答下列问题:
(1)基态Ti原子的价电子排布式为_______,基态Ti原子核外存在_______对自旋相反的电子。
(2)TiCl4熔点为23℃,沸点为136℃,TiCl4晶体属于_______晶体。TiCl4可由TiO2与COCl2在一定条件下反应得到,反应的化学方程式为_______,COCl2中共价键类型为_______,C原子的杂化轨道类型是_______,与COCl2互为等电子体的分子为_______。C、O、Cl的电负性由小到大的顺序为_______。
(3)金红石型TiO2晶胞如图,如果晶胞的边长为apm,则它的密度为_______g/cm3(列出计算式即可)。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志,长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖(C6H12O6),下列说法不正确的是___(填序号);
A.糖尿病人尿糖偏高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
B.葡萄糖属于碳水化合物,分子可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)含糖类丰富的农产品通过发酵法可以制取乙醇,但随着石油化工的发展,工业上主要是以乙烯为原料,在加热、加压和有催化剂存在的条件下跟水反应生成乙醇,这种方法叫做乙烯水化法,试写出该反应的化学方程式:___,该反应的反应类型是____;
(3)今有有机物A,B,分子式不同,均可能含C,H,O元素中的两种或三种,如果将A,B不论以何种比例混合,只要物质的量之和不变,完全燃烧时所消耗的氧气和生成的水的物质的量也不变,若A是甲烷,则符合上述条件的有机物B中分子量最小的是___(写化学式),并写出分子量最小的含有﹣CH3(甲基)的B的两种同分异构体的结构简式____、____;
(4)分析下表所列数据,可以得出的结论是(写出2条即可)____。
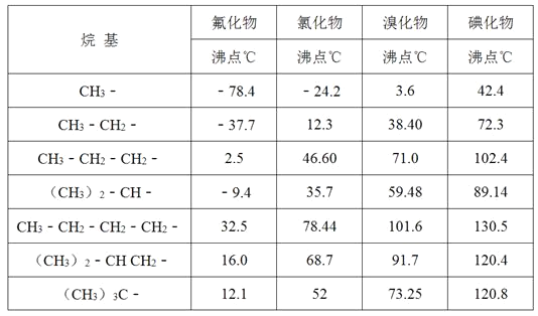
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com