
����Ŀ��A��B��C��D ��ԭ���������������ͬһ��ͬ��Ԫ�أ�A��B �ǽ���Ԫ�أ�C��D �Ƿǽ���Ԫ�أ�A��B������������Ӧ��ˮ������Է�����Ӧ�����κ�ˮ��
(1)A �� C ���γɻ����� A2C��д���û�����ĵ���ʽΪ_____��
(2)B �� D �γɵĻ�������_____(�������ӻ��������������ۻ�������)����֤�ý� �۵�ʵ�鷽����_____��
(3)C �ĵͼ�������ͨ�� D ���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪ_____��
(4)�� C ����ۺ����� W ����Һ���������Һ(���ʵ���Ũ��Ϊ 5.2mol/L�����Ϊ1L�� ���跴Ӧǰ����Һ����仯���Բ���)��װ��ԭ�����ͼ��ʾ��

���� a �缫�Ϸ����ķ�Ӧ�ɱ�ʾΪ_____��
������ع���һ��ʱ���a ������ 0.05molPb�� b �缫�������仯Ϊ________g�����ʱ W ��Һ��Ũ�� Ϊ___________mol/L��
���𰸡�![]() ���ۻ����� ���û��������������״̬��������ʵ�飬����û�����������״̬�²����磬˵���û������ǹ��ۻ����� SO2+Cl2+2H2O=H2SO4+2HCl Pb-2e-+SO42-=PbSO4 3.2 5.1
���ۻ����� ���û��������������״̬��������ʵ�飬����û�����������״̬�²����磬˵���û������ǹ��ۻ����� SO2+Cl2+2H2O=H2SO4+2HCl Pb-2e-+SO42-=PbSO4 3.2 5.1
��������
A��B �ǽ���Ԫ�أ�A��B������������Ӧ��ˮ������Է�����Ӧ�����κ�ˮ��A��NaԪ�ء�B��AlԪ�أ�Na�� C ���γɻ����� A2C��C��-2�ۣ�C��SԪ�أ�A��B��C��D ��ԭ������������������D��ClԪ�ء�
�������Ϸ�����(1) A��NaԪ�ء�C��SԪ�أ��γɻ�����Na2S�����ӻ��������ʽΪ![]() ��
��
(2) B��AlԪ�ء� D��ClԪ�أ��γɵĻ�����AlCl3�ǹ��ۻ�������ۻ�����������״̬�²����磬���û��������������״̬��������ʵ�飬����û�����������״̬�²����磬˵���û������ǹ��ۻ����
(3)S�ĵͼ���������SO2�� D ������������SO2ͨ����ˮ������Ӧ�Ļ�ѧ����ʽΪSO2+Cl2+2H2O=H2SO4+2HCl��
(4) H2SO4��Һ��Pb��PbO2����ԭ��أ�Pb�Ǹ�����PbO2��������
��a ���Ǹ�����Pbʧ��������PbSO4������a�缫�Ϸ����ķ�Ӧ�ɱ�ʾΪPb-2e-+SO42-=PbSO4��
��b��������b�缫��Ӧʽ��PbO2+2e-+4H++SO42-=PbSO4+2H2O��a ������ 0.05molPb��ת�Ƶ��ӵ����ʵ�����0.1mol�� b �缫����0.05mol PbO2������0.05mol PbSO4�����仯Ϊ![]() 3.2g�������ܷ�ӦʽPb+ PbO2+ H2SO4= 2PbSO4+2H2O��a ������ 0.05molPb���ܷ�Ӧ����0.1mol H2SO4����ʱ H2SO4��Һ��Ũ�� Ϊ
3.2g�������ܷ�ӦʽPb+ PbO2+ H2SO4= 2PbSO4+2H2O��a ������ 0.05molPb���ܷ�Ӧ����0.1mol H2SO4����ʱ H2SO4��Һ��Ũ�� Ϊ![]() =5.1mol/L��
=5.1mol/L��


 ��������������������ϵ�д�
��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ����ͺ���Ԫ�صĻ��ϼ����о��������ʵ�������Ҫ�Ƕȡ���ͼ����Ԫ�صļ����άͼ���ش��������⣺

(1)ͼ���ѱ�����������(����X��Y)�����ڵ���ʵ���______________�֡�
(2)X�Ļ�ѧʽΪ________����״���£�______mol Y��3.36L SO2������ͬ��Ŀ����ԭ�ӡ�
(3)ijͬѧ��ѡ����ͼ�IJ���װ�ú�ҩƷ̽��SO2�����ʡ�
A. 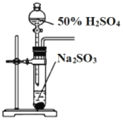 B. ��ˮ
B. ��ˮ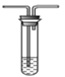 C.����������Һ
C.����������Һ 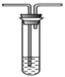 D. ʯ����Һ
D. ʯ����Һ E. H2S��Һ
E. H2S��Һ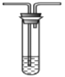
��Ϊ��֤SO2���������Ժͻ�ԭ�ԣ�װ������˳��Ϊ__________(����ĸ��ʾ)������SO2���л�ԭ�Եķ�Ӧ����ʽΪ______________��
�����з�Ӧ�У�������SO2���ͨ�Ե���___________��
A.SO2 + H2OH2SO3
B.2SO2 + O2![]() 2SO3
2SO3
C.SO2 + 2NaOH = Na2SO3 + H2O
D.SO2 + CaO = CaSO3
(4)��ͬѧ�����ͼװ�ý�һ��̽��п��Ũ���ᷴӦ������SO2�⣬�Ƿ����������ɡ�(XΪп��Ũ���Ṳ��ʱ����������)

��B�м�����Լ���___________��E��������_______��
�ڿ���֤������X�к���������ʵ��������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. 0.1mol/LpHΪ4��NaHB��Һ�У�c (HB-)>c(H2B)>c(B2-)
B. ��ͼ��ʾ25��ʱ����0.1mol��L-1����ζ�20mL0.1mol��L-1NaOH��Һʱ����Һ��pH�����������ı仯

C. ��pH=2��NaHSO4��Һ��c(H+)=c(OH-)+ c(SO42-)
D. pH=2������һԪ��x��y�������Ϊ100 mL��ϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ���ֱ�μ�NaOH��Һ(c=0.1mol��L-1)��pH=3������NaOH��Һ�����ΪVx��Vy����xΪǿ�ᣬyΪ������Vx>Vy

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�ʹ2 mol A��4 mol B��Ϸ������з�Ӧ��
A(g)��2B(g) ![]() 2C(g)����H<0��
2C(g)����H<0��
(1)����Ӧ�ﵽƽ��ʱ��A��B��Ũ�ȱ���_______��A��B��ת���ʱ���_______��
(2)����ƽ����ϵ���¶�(�����������)����������ƽ����Է�������_________���ܶ�_________��(���������������С������������)
(3)���ﵽƽ��ʱ�����������������ѹǿ���䣬ƽ�⽫________(����������������������������)�ƶ���
(4)���������ݡ����ȣ�����ʹ�������¶�Ѹ������ԭ����2����ƽ�⽫________(���������ƶ������������ƶ����������ƶ���)���ﵽ��ƽ����������¶�______(��������������С��������������)ԭ����2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������

A. ͼ1��ʾ��ˮ��ͨ��HCl���壬��Һ�ĵ��������仯
B. ͼ2��ʾ��Ӧ��X(g)+2Y(g) ![]() 3Z(g)��b���߱�ʾ��һ��������ѹǿ
3Z(g)��b���߱�ʾ��һ��������ѹǿ
C. ͼ3�ɱ�ʾpH��ͬ��NaOH��Һ�백ˮϡ���̵�pH�仯����������a��Ӧ��ˮ
D. ͼ4�ɱ�ʾ��0.100 0 mol/L������ζ�40.00 mL 0.100 0 mol/L NaOH��Һ�õ��ĵζ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���NO(g)��O2(g)�����ʵ���֮��2��1���뷴Ӧ������������Ӧ��2NO(g) + O2(g) ![]() 2NO2(g)������������ͬʱ���ֱ���NO��ƽ��ת�����ڲ�ͬѹǿ��p1��p2�������¶ȱ仯����������ͼ��ʾ������˵����ȷ����
2NO2(g)������������ͬʱ���ֱ���NO��ƽ��ת�����ڲ�ͬѹǿ��p1��p2�������¶ȱ仯����������ͼ��ʾ������˵����ȷ����

A. p1 < p2
B. �����������䣬�¶����ߣ��÷�Ӧ�ķ�Ӧ������
C. 400�桢p1�����£�O2��ƽ��ת����Ϊ20%
D. 400��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ������ֵΪ10/9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����Ũ�ȵ�NaOH��Һ�ֱ�μӵ���pH���������HA��HB����������Һ�У���Һ��pH������Ũ�ȱ�ֵ�Ķ�����ϵ��ͼ��ʾ����������������ǣ� ��

A. a��ʱ����Һ����ˮ�����c(OH-)ԼΪ1��10-10 mol��L-1
B. ����ƽ�ⳣ����Ka(HA)< Ka(HB)
C. b��ʱ��c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. ��HB��Һ�еμ�NaOH��Һ��pH=7ʱ��c(B-)> c(HB)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ƣ�Na2S2O4����Ҳ��Ϊ���շۣ�Na2S2O4������ˮ���������Ҵ������м�ǿ�Ļ�ԭ�ԣ��ױ������������ڼ��Խ������ȶ����������ӵĽṹ��ͼ��ʾ��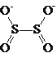 ��ij����С���Ʊ���̽�������ʡ�
��ij����С���Ʊ���̽�������ʡ�
�����Ʊ�Na2S2O4�����ȵȸ���������ȥ��
��1��Na2S2O4����Ԫ�صĻ��ϼ�Ϊ_______��
��2�����Ӻ�װ�ú�������������õIJ�����____________________��
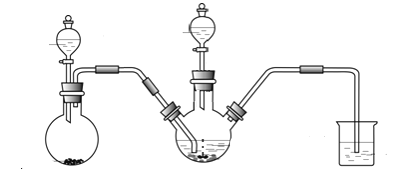
��3������ҩƷ���ٴ����Ӻ�װ�ã�
����һ������A�����ɵ�����ͨ��B�н��з�Ӧ����Bװ����������������п�Ļ��Ϸ�Ӧ����ʽΪ__________��
���ڶ���������NaOH��Һ����28��35���·�Ӧ����Na2S2O4���ò���Ӧ�����ӷ���ʽΪ_____________��
�����������ڶ����Ļ������ˣ�������Һ�м������NaCl����ȴ��20��������Na2S2O4����������
�����IJ��������������û���ᆳ________����������ƣ���________(��д ��ˮ�������Ҵ���)ϴ�ӣ��õ�������Na2S2O4���塣
��4��װ��C�������� _______________��
����̽��Na2S2O4���ȶ���
��5��������������Na2S2O4������ȫ�ֽ�õ��������Na2SO3��Na2S2O3��SO2��������С��û��������ȫ�����������õ��Ĺ�������л�����Na2SO4�������ʵ��֤���÷ֽ�����к���Na2SO4��ʵ�鷽����______________������ѡ�Լ���ϡ���ᡢϡ���ᡢϡ���ᡢBaCl2��Һ��AgNO3��Һ��KMnO4��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� X��Y��Z��W��Ϊ������Ԫ�أ�������Ԫ�����ڱ���λ������ͼ��ʾ����Yԭ�ӵ��������������������֮��Ϊ3:4������˵����ȷ����

A. ԭ�Ӱ뾶��W>Z>Y>X
B. ����������Ӧˮ��������ԣ�Z>W>X
C. ��̬�⻯����ȶ��ԣ�Z>W
D. W�ĵ�������ˮ��Ӧ������һ�־���Ư���Ե�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com