
【题目】我国成功研制的新型可充电 AGDIB电池(铝—石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为CxPF6+LiyAl=Cx+LiPF6+Liy-1Al。放电过程如图,下列说法正确的是( )
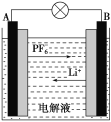
A.B为负极,放电时铝失电子
B.充电时,与外加电源负极相连一端电极反应为LiyAl-e-=Li++Liy-1Al
C.充电时A电极反应式为Cx+PF![]() -e-=CxPF6
-e-=CxPF6
D.废旧 AGDIB电池进行“放电处理”时,若转移1 mol电子,石墨电极上可回收7 g Li
科目:高中化学 来源: 题型:
【题目】某小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
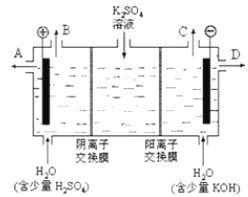
(1)该电解槽的阳极反应为________________________,此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2) 制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”、“D”)导出,制得的氧气从出口________ (填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________ 。
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:
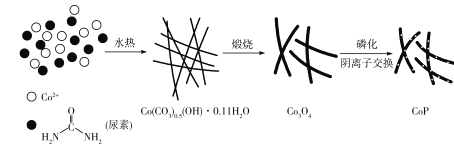
(1)基态P原子的电子排布式为___。P在元素周期表中位于___区。
(2)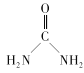 中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
(3)CO32-中C的价层电子对数为___,其空间构型为___。
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加德罗常数的值, 则其晶胞密度为___g.cm-3(列出计算式即可)。
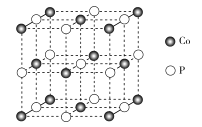
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,11.2 L SO2含有的氧原子数小于NA
B.0. 1 mol Na2O2和Na2O的混合物中含有的离子总数等于0.4NA
C.10 g质量分数为34%的H2O2溶液含有的氢原子数为0.2NA
D.100 mL 0.1 mol/L醋酸中含有的醋酸分子数是0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
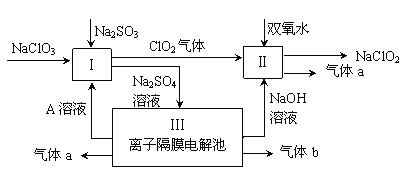
(1)双氧水的结构式为:___________;Ⅰ中发生反应的还原剂是_____(填化学式)。
(2)Ⅱ中反应的离子方程式是_______________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式_______。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因_______________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量_______(填相同、不相同或无法判断)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为2 L的密闭容器中发生反应2X(g)+Y(g)![]() 2W(g) ΔH<0,当充入2 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是( )
2W(g) ΔH<0,当充入2 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是( )
①升高温度,W的体积分数减小,ΔH增大 ②以Y的浓度变化表示的反应速率为0.01 mol·L-1·s-1 ③在其他条件不变的情况下,增加1 mol X,则X和Y的转化率均提高 ④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动 ⑤再向容器中通入2 mol X和1 mol Y,达到平衡时,X、Y的转化率均增大
A. ⑤ B. ①⑤ C. ②③④ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)是新型锂离子电池常用的正极材料。工业上以软锰矿浆为原料可制备锰酸锂,同时制得副产品MnSO4·H2O晶体,其流程如图所示。
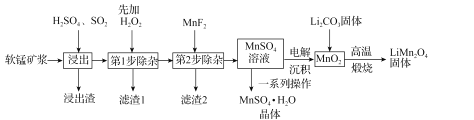
已知:(1)软锰矿浆的主要成分为MnO2,还含有Fe2O3,MgO、Al2O3,CaO,SiO2等杂质。
(2)温度高于27℃时,MnSO4晶体的溶解度随温度升高而逐渐降低。
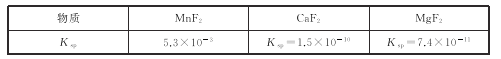
(3)有关物质的溶度积常数如下表:
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为_____。该过程中,为提高软锰矿中MnO2的浸出率,下列措施可行的有_____(填字母)。
A.不断搅拌,使SO2和软锰矿浆充分接触
B.增大通入SO2的流速
C.适当升温
D.减少软锰矿浆的进入量
(2)第1步除杂中加入H2O2的目的是_____。
(3)第2步除杂,主要是将Ca2+,Mg2+转化为相应的氟化物沉淀除去,其中MnF2除去Mg2+反应的离子方程式为MnF2(s)+Mg2+(aq)=Mn2+(aq)+MgF2(s),该反应的平衡常数为_____。
(4)图中的一系列操作指的是_____。
(5)将MnO2和Li2CO3按4:1的物质的量之比配料,混合搅拌,然后高温煅烧600~750℃,制取产品LiMn2O4。写出该反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压强变化不会使下列化学反应的平衡发生移动的是( )
A. C(s)+CO2(g)![]() 2CO(g)B. 3H2(g)+N2(g)
2CO(g)B. 3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
C. 2SO2(g)+O2(g)![]() 2SO3(g)D. H2(g)+I2(g)
2SO3(g)D. H2(g)+I2(g)![]() 2HI(g)
2HI(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com