
【题目】某小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
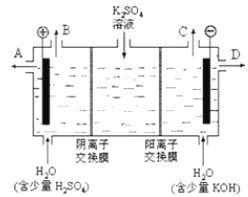
(1)该电解槽的阳极反应为________________________,此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2) 制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”、“D”)导出,制得的氧气从出口________ (填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________ 。
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为___________
【答案】2H2O-4e-===O2↑+4H+ 小于 D B H+放电,促进水的电离,OH-浓度增大 O2+2H2O+4e-===4OH-
【解析】
(1)电解时,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极上失电子发生氧化反应;根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断。
(2)根据氢氧化钠和氧气生成的电极判断导出口。
(3)根据放电的离子判断PH增大的原因。
(4)燃料原电池中,正极上氧化剂得电子发生还原反应,写出相应的电极反应式,注意结合电解质溶液的酸碱性书写。
(1)电解时,阳极上失电子发生氧化反应,反应为2H2O-4e-===O2↑+4H+;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数。
故答案为:2H2O-4e-===O2↑+4H+;小于;
(2)氢氧化钾在阴极生成,所以在D口导出;氧气在阳极生成,且氧气是气体,所以从B口导出。
故答案为:D;B;
(3)通电开始后,阴极上氢离子放电生成氢气,氢离子来自于水,所以促进水的电离,导致溶液中氢氧根离子的浓度大于氢离子的浓度,所以溶液的pH值增大。
故答案为:H+放电,促进水的电离,OH-浓度增大;
(4)燃料原电池中,燃料在负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,该燃料原电池中,氧气是氧化剂,所以氧气在正极上得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-===4OH-。
故答案为:O2+2H2O+4e-===4OH-。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
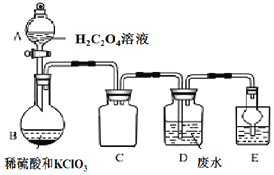
【题目】某工业废水中含有的 Mn2+、CN﹣等会对环境造成污染,在排放之前必须进行处理。ClO2是一种国际上公认的安全无毒的绿色水处理剂,某实验兴趣小组通过如图装置制备 ClO2,并用它来处理工业废水中的 Mn2+、CN﹣。
已知:i.ClO2 为黄绿色气体,极易溶于水,沸点 11℃;
ii.ClO2 易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低;
iii.某工业废水处理过程中 Mn2+转化为 MnO2、CN﹣转化为对大气无污染的气体;
iv.装置 B 中发生的反应为:H2C2O4+H2SO4+2KClO3═K2SO4+2CO2↑+2ClO2↑+2H2O。
请回答下列问题:
(1)B 装置的名称是_____,C 装置的作用为_____。
(2)用 H2C2O4 溶液、稀硫酸和 KC1O3 制备 ClO2 的最大优点是_____。
(3)写出装置 D 中除去 Mn2+的离子方程式_____。
(4)ClO2 在处理废水过程中可能会产生副产物亚氯酸盐(ClO2 )。下列试剂中,可将 ClO2 转化为 Cl
的是_____。(填字母序号)。
a.FeSO4 b.O3 c.KMnO4 d.SO2
(5)在实验室里对该废水样品中 CN﹣含量进行测定:取工业废水Wg于锥形瓶中,加入10mL0.10mol/L 的硫酸溶液,用 0.0200mol/L 的 KMnO4标准溶液进行滴定,当达到终点时共消耗 KMnO4 标准溶液25.00mL。
在此过程中:
①实验中使用棕色滴定管的原因是_____,滴定终点的判断依据是_____。
②W g 工业废水中 CN﹣的物质的量为_____。
③若盛装工业废水的锥形瓶未润洗,则测定结果将_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成涤纶的流程图如下所示。
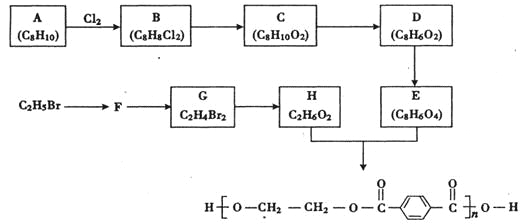
回答下列问题:
(1)A的名称为 ;
(2) F的结构简式是 ;
(3) C→D的反应类型是 ;F→G的反应类型为 ;
(4)E与H反应的化学方程式为 :
(5)E有多种同分异构体,符合下列条件的同分异构体有 种,其中在核磁共振氢谱中出现四组峰的是 (写出结构简式)。
①芳香族化合物;②红外光谱显示含有羧基;③能发生银镜反应;④能发生水解反应
(6) A也能一步转化生成E:![]() .试剂a可以用 溶液。
.试剂a可以用 溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化碳酰胺[CO(NH2)2·H2O2]是一种与过氧化氢性质相似的固体氧化剂,因其具有价廉、安全、易于储存、使用方便等优点,被广泛应用于日用化工、食品、建筑、农业等领域。请回答下列问题:
I.过氧化碳酰胺的制备
实验室用尿素和双氧水制备过氧化碳酰胺的步骤如下:取5.0 mL 30% H2O2放入50 mL锥形瓶中,加入1.8 g尿素(H2O2与尿素的物质的量之比为3:2);将装有反应混合物的锥形瓶放入水浴锅中,水浴加热至60 °C,加热几分钟,得到一种澄清、透明的溶液;将溶液转移到大蒸发皿上,在60 °C恒温水浴锅上缓慢蒸发;溶液中缓慢析出针状晶体;当结晶完全后,将针状晶体用滤纸吸去水分,称重,得产品2.5 g。
已知:CO(NH2)2+H2O2=CO(NH2)2·H2O2。
(1)H2O2的电子式为________________________。
(2)水浴加热时温度控制在60 °C最好,其原因为___________________________。
(3)过氧化碳酰胺的产率为___________%(结果保留1位小数)。
II.过氧化碳酰胺的性质
称取0.50g过氧化碳酰胺于试管中,加5mL水溶解。
过氧化碳酰胺的鉴定反应步骤及现象如下:
在试管中加入5滴过氧化碳酰胺溶液、0.5 mL乙醚和2滴2 mol·L-1 H2SO4酸化,再加入2~3滴0.1 mol. L-1K2CrO4溶液.振荡试管,上层呈深蓝色,过氧化氢和重铬酸钾发生非氧化还原反应生成蓝色的CrO5,CrO5在乙醚中稳定,碳酰胺[CO(NH2)2]不和重铬酸钾反应,下层呈绿色,CrO5在水中不稳定,易分解生成Cr(OH)2+和O2。
(4)检验O3可用CrO3与O3反应,得蓝色晶体CrO5:CrO3+O3 →CrO5(未配平),则该反应中氧化剂与还原剂的个数比为_____________。
(5)CrO5在水中分解的离子方程式为_______________。
III.过氧化碳酰胺中活性氧含量的测定(以过氧化氢中氧原子的质量分数计)
准确称量7.5200 g产品,配制成100 mL溶液,用移液管移取10.00 mL溶液于250 mL锥形瓶中,加人适量水和硫酸,用0.1000mol·L-1的酸性高锰酸钾标准溶液平行滴定三次,平均消耗的体积为24.00mL。.
(6)配制100mL过氧化碳酰胺溶液所用到的玻璃仪器有____________,判断滴定至终点的现象为___________________,过氧化碳酰胺中活性氧含量为_____________(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为 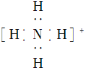 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种全天候太阳能电池光照时的工作原理如图所示。
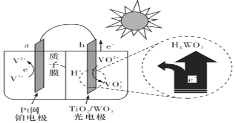
下列说法不正确的是( )
A.硅太阳能电池供电原理与该电池相同
B.光照时,b极的电极反应式为VO2+﹣e-+H2O=VO2++2H+
C.光照时,毎转移1mol电子,有2molH+由b极区经质子交换膜向a极区迁移
D.夜间时,该电池相当于蓄电池放电,a极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯容易发生聚合生成二聚体,该反应为![]() 。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
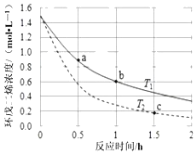
A.T1<T2
B.a点的正反应速率小于b点的逆反应速率
C.a点的反应速率小于c点的反应速率
D.反应开始至b点时,双环戊二烯平均速率约为:0.45molL-1h-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )

A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的新型可充电 AGDIB电池(铝—石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为CxPF6+LiyAl=Cx+LiPF6+Liy-1Al。放电过程如图,下列说法正确的是( )
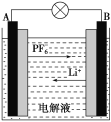
A.B为负极,放电时铝失电子
B.充电时,与外加电源负极相连一端电极反应为LiyAl-e-=Li++Liy-1Al
C.充电时A电极反应式为Cx+PF![]() -e-=CxPF6
-e-=CxPF6
D.废旧 AGDIB电池进行“放电处理”时,若转移1 mol电子,石墨电极上可回收7 g Li
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com