
【题目】过氧化碳酰胺[CO(NH2)2·H2O2]是一种与过氧化氢性质相似的固体氧化剂,因其具有价廉、安全、易于储存、使用方便等优点,被广泛应用于日用化工、食品、建筑、农业等领域。请回答下列问题:
I.过氧化碳酰胺的制备
实验室用尿素和双氧水制备过氧化碳酰胺的步骤如下:取5.0 mL 30% H2O2放入50 mL锥形瓶中,加入1.8 g尿素(H2O2与尿素的物质的量之比为3:2);将装有反应混合物的锥形瓶放入水浴锅中,水浴加热至60 °C,加热几分钟,得到一种澄清、透明的溶液;将溶液转移到大蒸发皿上,在60 °C恒温水浴锅上缓慢蒸发;溶液中缓慢析出针状晶体;当结晶完全后,将针状晶体用滤纸吸去水分,称重,得产品2.5 g。
已知:CO(NH2)2+H2O2=CO(NH2)2·H2O2。
(1)H2O2的电子式为________________________。
(2)水浴加热时温度控制在60 °C最好,其原因为___________________________。
(3)过氧化碳酰胺的产率为___________%(结果保留1位小数)。
II.过氧化碳酰胺的性质
称取0.50g过氧化碳酰胺于试管中,加5mL水溶解。
过氧化碳酰胺的鉴定反应步骤及现象如下:
在试管中加入5滴过氧化碳酰胺溶液、0.5 mL乙醚和2滴2 mol·L-1 H2SO4酸化,再加入2~3滴0.1 mol. L-1K2CrO4溶液.振荡试管,上层呈深蓝色,过氧化氢和重铬酸钾发生非氧化还原反应生成蓝色的CrO5,CrO5在乙醚中稳定,碳酰胺[CO(NH2)2]不和重铬酸钾反应,下层呈绿色,CrO5在水中不稳定,易分解生成Cr(OH)2+和O2。
(4)检验O3可用CrO3与O3反应,得蓝色晶体CrO5:CrO3+O3 →CrO5(未配平),则该反应中氧化剂与还原剂的个数比为_____________。
(5)CrO5在水中分解的离子方程式为_______________。
III.过氧化碳酰胺中活性氧含量的测定(以过氧化氢中氧原子的质量分数计)
准确称量7.5200 g产品,配制成100 mL溶液,用移液管移取10.00 mL溶液于250 mL锥形瓶中,加人适量水和硫酸,用0.1000mol·L-1的酸性高锰酸钾标准溶液平行滴定三次,平均消耗的体积为24.00mL。.
(6)配制100mL过氧化碳酰胺溶液所用到的玻璃仪器有____________,判断滴定至终点的现象为___________________,过氧化碳酰胺中活性氧含量为_____________(结果保留1位小数)。
【答案】![]() 若加热温度低于60℃,则反应速率慢,若加热温度高于60℃,则尿素和双氧水会分解,影响产率 88.7 2:3 4CrO5+8H+=4Cr(OH)2++7O2↑+2H2O 100mL容量瓶、玻璃棒、烧杯、胶头滴管 当滴入最后一滴酸性高锰酸钾标准溶液时,溶液由无色变为浅红色,且半分钟(或30s)内不褪色 25.5%
若加热温度低于60℃,则反应速率慢,若加热温度高于60℃,则尿素和双氧水会分解,影响产率 88.7 2:3 4CrO5+8H+=4Cr(OH)2++7O2↑+2H2O 100mL容量瓶、玻璃棒、烧杯、胶头滴管 当滴入最后一滴酸性高锰酸钾标准溶液时,溶液由无色变为浅红色,且半分钟(或30s)内不褪色 25.5%
【解析】
(1)H2O2的结构式为H-O-O-H,然后书写出其电子式;
(2)利用温度对化学反应速率以及H2O2稳定性的影响进行分析;
(3)投入H2O2和尿素的物质的量之比为3:2,根据反应方程式,过氧化氢过量,按照尿素进行计算;
(4)过氧化氢和重铬酸钾溶液发生非氧化还原反应得到CrO5,即CrO5中Cr显+6价,O有-1价和-2价,需要计算CrO5中-1价O和-2价O的个数,然后配平方程式;
(5)根据题意,CrO5在水中不稳定,易分解成Cr(OH)2+和O2,然后利用原子和电荷守恒,进行书写;
(6)根据配制溶液需要的仪器进行分析;用酸性高锰酸钾溶液滴定溶液,高锰酸钾溶液显紫红色,分析得出滴定终点;利用关系法进行计算;
(1)H2O2为共价化合物,其结构式为H-O-O-H,电子式为![]() ;
;
(2)过氧化氢和尿酸发生反应时,控制温度在60℃,可保证反应速率不是太慢,又可使尿素和过氧化氢不分解,因此控制温度在60℃的原因是若加热温度低于60℃,则反应速率慢,若加热温度高于60℃,则尿素和双氧水会分解,影响产率;
(3)根据尿素与过氧化氢反应的方程式,按照过氧化氢与尿素的物质的量之比为3:2,过氧化氢过量,应按照尿素进行计算,理论上生成过氧化碳酰胺质量为![]() =2.82g,则产率为
=2.82g,则产率为![]() =88.7%;
=88.7%;
(4)过氧化氢和重铬酸钾发生非氧化还原反应生成蓝色的CrO5,CrO5中Cr的化合价为+6价,CrO5中O显-1价和-2价,令1molCrO5中含xmol-1价O,ymol-2价O,则有x+y=5,根据化合价代数和为0,则有x+2y=6,解得x=4,y=1,依据氧化还原反应中的归中规律,该反应方程式为3CrO3+2O3=3CrO5,即氧化剂与还原剂的物质的量之比为2:3,即个数之比为2:3;
(5) 根据题意,CrO5在酸性条件下分解成Cr(OH)2+和O2,根据原子守恒和电荷守恒 ,分解的离子方程式为4CrO5+8H+=4Cr(OH)2++7O2↑+2H2O;
(6)配制过氧化碳酰胺需要的玻璃仪器有100mL容量瓶、玻璃棒、烧杯、胶头滴管;用酸性高锰酸钾溶液进行滴定,因此滴定终点的现象:当滴入最后一滴酸性高锰酸钾标准溶液时,溶液由无色变为浅红色,且半分钟(或30s)内不褪色;过氧化碳酰胺与H2O2性质相似,酸性高锰酸钾溶液相当于滴定H2O2,因此建立关系式为5[CO(NH2)2·H2O2]~5H2O2~2KMnO4,由此可得到过氧化碳酰胺中活性氧含量为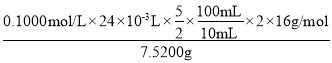 ×100%=25.5%。
×100%=25.5%。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,![]() 的名称为2,7,7-三甲基-3-乙基辛烷
的名称为2,7,7-三甲基-3-乙基辛烷
B.裂化汽油是一种良好的有机溶剂,可以用于清洗衣物油渍和萃取溴水中的卤素
C.DDT的结构简式为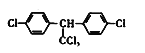 ,分子中最多有13个碳原子共平面
,分子中最多有13个碳原子共平面
D.![]() 的单体是CH3-C≡C-CH3和CH2=CH-CN
的单体是CH3-C≡C-CH3和CH2=CH-CN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室电解Na2SO4溶液的装置,下列叙述错误的是( )
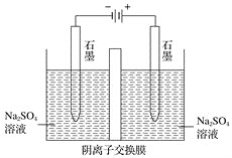
A.阴极:2H++2e-=H2↑,阳极:4OH--4e-=2H2O+O2↑
B.电解一段时间后,阴极区显碱性,阳极区显酸性
C.电解过程中,Na+、H+向阴极定向移动,SO42-、OH-向阳极定向移动
D.电解后,撤掉阴离子交换膜充分混合,Na2SO4溶液的浓度比电解前增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与体积(V)的关系如图所示,则下列说法正确的是( )
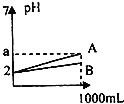
A.A、B两种酸溶液物质的量浓度一定相等
B.若a=5,则A是强酸,B是弱酸
C.稀释后A酸溶液的酸性比B酸溶液强
D.若a<5,则A.B都是弱酸且A的酸性>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是
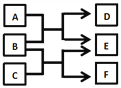
A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
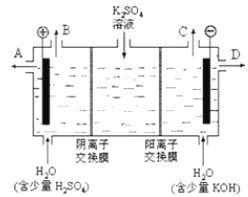
(1)该电解槽的阳极反应为________________________,此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2) 制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”、“D”)导出,制得的氧气从出口________ (填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________ 。
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
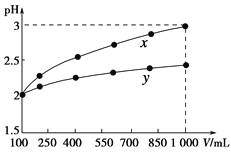
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com