
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是
A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
【答案】B
【解析】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1D溶液的pH为13(25℃),则D溶液为一元强碱溶液,且其中的金属元素在短周期,则金属元素为Na元素,所以D是NaOH,A和B反应生成强碱,且A和B都是化合物,E是单质,则该反应是过氧化钠和水的反应,所以E是O2,则Z元素是O元素,W的原子序数大于Z,所以W是Na元素;B和C反应生成氧气,两种化合物反应生成氧气的还有过氧化钠和二氧化碳的反应,所以B是Na2O2,则A是H2O,C是CO2,F是Na2CO3,X的原子序数小于Y,则X是H元素,Y是C元素,即X是H、Y是C、Z是O、W是Na元素,A.由X、Y、Z、W四种元素组成的盐是碳酸氢钠,其溶液pH大于7,A错误;B.化合物F是Na2CO3,碳酸钠中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在共价键,所以碳酸钠中含有共价键和离子键,B正确;C.B是Na2O2,C是CO2,在B和C的反应中,氧化剂和还原剂都是过氧化钠,0.1molB与足量C完全反应共转移电子数为0.1NA,C错误;D.Z是O元素,其没有正化合价,D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCN(aq)+NaOH(aq)=NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;
则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1B.-45.2 kJ·mol-1C.+45.2 kJ·mol-1D.+69.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化碳酰胺[CO(NH2)2·H2O2]是一种与过氧化氢性质相似的固体氧化剂,因其具有价廉、安全、易于储存、使用方便等优点,被广泛应用于日用化工、食品、建筑、农业等领域。请回答下列问题:
I.过氧化碳酰胺的制备
实验室用尿素和双氧水制备过氧化碳酰胺的步骤如下:取5.0 mL 30% H2O2放入50 mL锥形瓶中,加入1.8 g尿素(H2O2与尿素的物质的量之比为3:2);将装有反应混合物的锥形瓶放入水浴锅中,水浴加热至60 °C,加热几分钟,得到一种澄清、透明的溶液;将溶液转移到大蒸发皿上,在60 °C恒温水浴锅上缓慢蒸发;溶液中缓慢析出针状晶体;当结晶完全后,将针状晶体用滤纸吸去水分,称重,得产品2.5 g。
已知:CO(NH2)2+H2O2=CO(NH2)2·H2O2。
(1)H2O2的电子式为________________________。
(2)水浴加热时温度控制在60 °C最好,其原因为___________________________。
(3)过氧化碳酰胺的产率为___________%(结果保留1位小数)。
II.过氧化碳酰胺的性质
称取0.50g过氧化碳酰胺于试管中,加5mL水溶解。
过氧化碳酰胺的鉴定反应步骤及现象如下:
在试管中加入5滴过氧化碳酰胺溶液、0.5 mL乙醚和2滴2 mol·L-1 H2SO4酸化,再加入2~3滴0.1 mol. L-1K2CrO4溶液.振荡试管,上层呈深蓝色,过氧化氢和重铬酸钾发生非氧化还原反应生成蓝色的CrO5,CrO5在乙醚中稳定,碳酰胺[CO(NH2)2]不和重铬酸钾反应,下层呈绿色,CrO5在水中不稳定,易分解生成Cr(OH)2+和O2。
(4)检验O3可用CrO3与O3反应,得蓝色晶体CrO5:CrO3+O3 →CrO5(未配平),则该反应中氧化剂与还原剂的个数比为_____________。
(5)CrO5在水中分解的离子方程式为_______________。
III.过氧化碳酰胺中活性氧含量的测定(以过氧化氢中氧原子的质量分数计)
准确称量7.5200 g产品,配制成100 mL溶液,用移液管移取10.00 mL溶液于250 mL锥形瓶中,加人适量水和硫酸,用0.1000mol·L-1的酸性高锰酸钾标准溶液平行滴定三次,平均消耗的体积为24.00mL。.
(6)配制100mL过氧化碳酰胺溶液所用到的玻璃仪器有____________,判断滴定至终点的现象为___________________,过氧化碳酰胺中活性氧含量为_____________(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
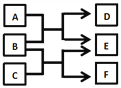
【题目】某小组为探究K3[Fe(C2O4)3·3H2O(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验。下列有关叙述错误的是( )
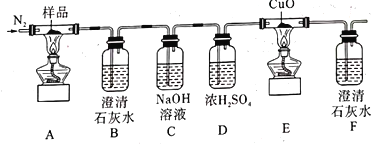
A.通入氮气的目的有;隔绝空气、使反应产生的气体全部进人后续装置
B.实验中观察到装置F中澄清石灰水变浑浊,装置E中固体变为红色,由此可判断热分解产物中一定含有CO2和CO
C.为防止倒吸,停止实验时应进行的操作是:先熄灭装置A、E的酒精灯,冷却后停止通人氮气
D.样品完全分解后,取少许装置A中残留物于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,可证明残留物中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种全天候太阳能电池光照时的工作原理如图所示。
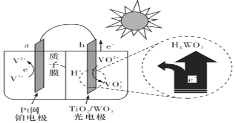
下列说法不正确的是( )
A.硅太阳能电池供电原理与该电池相同
B.光照时,b极的电极反应式为VO2+﹣e-+H2O=VO2++2H+
C.光照时,毎转移1mol电子,有2molH+由b极区经质子交换膜向a极区迁移
D.夜间时,该电池相当于蓄电池放电,a极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种药物合成的中间体,F的一种合成路线如下:

已知:

回答下列问题:
(1)![]() 的名称为____。
的名称为____。
(2)D中含氧官能团的名称为____。
(3)B→C的反应方程式为____。
(4)D→E的反应类型为____。
(5)C的同分异构体有多种,其中苯环上连有—ONa、2个—CH3的同分异构体还有____种,写出核磁共振氢谱为3组峰,峰面积之比为6:2:1的同分异构体的结构简式____。
(6)依他尼酸钠( )是一种高效利尿药物,参考以上合成路线中的相关信息,设计以
)是一种高效利尿药物,参考以上合成路线中的相关信息,设计以![]() 为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某废催化剂(含ZnO、CuO、Fe2O3、石墨及MnO2等)中回收金属并制取活性氧化锌的工艺流程如下(已知:Zn及其氧化物、氢氧化物的性质与Al及其相应化合物性质类似):
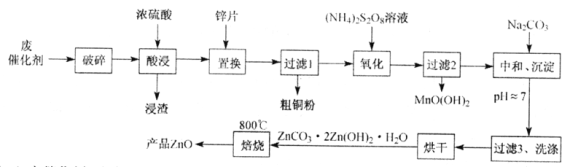
(1)废催化剂“破碎”的目的是____________________________________________。
(2)“氧化”时Mn2+被氧化的离子方程式为_________________________________。
(3)“中和、沉淀”时,若pH过高,则碱式碳酸锌的产率偏小。写出其反应的离子方程式(任写一个即可):____________________________________________。
(4)测得“粗铜粉”中铜的质量分数的实验步骤如下:
I.准确称取粗铜粉mg,加入足量盐酸和H2O2溶液使其完全溶解。
Ⅱ.将溶液煮沸1~2min,除去过量的H2O2。
Ⅲ.滴入铁掩蔽剂排除Fe3+的干扰。然后加入稍过量的KI溶液(反应:2Cu2++4I-=2CuI↓+I2),再加入几滴淀粉溶液作指示剂,用 c mol ·L-1Na2S2O3标准溶液滴定至蓝色消失(I2+2S2O32-=2I-+S4O62-)且半分钟内不变色,共消耗Na2S2O3标准溶液VmL。
①铜的质量分数为______________________。
②缺少步骤Ⅱ哙会使测得的铜的质量分数___________(填“偏大”、“偏小”、或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com