
【题目】某小组为探究K3[Fe(C2O4)3·3H2O(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验。下列有关叙述错误的是( )
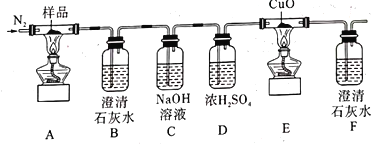
A.通入氮气的目的有;隔绝空气、使反应产生的气体全部进人后续装置
B.实验中观察到装置F中澄清石灰水变浑浊,装置E中固体变为红色,由此可判断热分解产物中一定含有CO2和CO
C.为防止倒吸,停止实验时应进行的操作是:先熄灭装置A、E的酒精灯,冷却后停止通人氮气
D.样品完全分解后,取少许装置A中残留物于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,可证明残留物中含有![]()
【答案】B
【解析】
探究三草酸合铁酸钾[K3[Fe(C2O4)3]3H2O]受热分解的产物,连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,装置A:三草酸合铁酸钾[K3[Fe(C2O4)3]3H2O]受热分解,装置B:将气体产物通过澄淸石灰水,观察到澄清石灰水变浑浊,有CO2生成,装置C:用氢氧化钠将CO2除尽,装置D:净化(干燥)剩余产物气体,装置E:检验CO(用CuO,变红),装置F:检验有CO2生成(CO的氧化产物),以此解答该题。
A.在反应开始前通入N2,可排净装置中的空气,以免O2和CO2对实验干扰,同时用N2把装置A、E中反应生成的气体排出进行后续检验,故A正确;
B.E中固体变红、F中澄清石灰水变浑浊证明分解产物中有还原性气体CO,只有B中澄清石灰水变浑浊才可证明分解产物中一定含有CO2,故B错误;
C.为防止倒吸,需要先关闭反应装置中的酒精灯,冷却至常温过程中需保持一直通入N2,故C正确;
D.结束实验后,待A中固体冷却至室温,取少量于试管中,加稀硫酸溶解,滴加1-2滴KSCN溶液,溶液变红,说明生成铁离子,即证明残留物中含有![]() ,故D正确;
,故D正确;
故答案为B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,请回答下列问题:
(1)金红石(TiO2)是钛的主要矿物之一,基态Ti原子价层电子的排布图为__,基态O原子电子占据最高能级的电子云轮廓图为__形。
(2)以TiO2为原料可制得TiCl4,TiCl4的熔、沸点分别为205K、409K,均高于结构与其相似的CCl4,主要原因是__。
(3)TiCl4可溶于浓盐酸得H2[TiCl6],向溶液中加入NH4Cl浓溶液可析出黄色的(NH4)2[TiCl6]晶体。该晶体中微观粒子之间的作用力有__。
A.离子键 B.共价键 C.分子间作用力 D.氢键 E.范德华力
(4)TiCl4可与CH3CH2OH、HCHO、CH3OCH3等有机小分子形成加合物。上述三种小分子中C原子的VSEPR模型不同于其他分子的是__,该分子中C的轨道杂化类型为__。
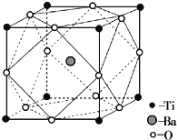
(5)TiO2与BaCO3一起熔融可制得钛酸钡。
①BaCO3中阴离子的立体构型为__。
②经X射线分析鉴定,钛酸钡的晶胞结构如图所示(Ti4+、Ba2+均与O2-相接触),则钛酸钡的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝苯地平H是一种治疗高血压的药物;其一种合成路线如下:

已知:酯分子中的a-碳原子上的氢比较活泼,使酯与酯之间能发生缩合反应。
![]()
回答下列问题:
(1)B的化学名称为________.
(2)②的反应类型是________.
(3)D的结构简式为________.
(4)H的分子式为________.
(5)反应①的化学方程式为________.
(6)已知M与G互为同分异构体,M在一定条体下能发生银镜反应,核磁共振氢谱显示有4组峰,峰面积之比为1:1:2:4,写出M的一种可能的结构简式________.
(7)拉西地平 也是一种治疗高血压药物,设以乙醇和
也是一种治疗高血压药物,设以乙醇和 为原料制备拉西地平的合成路线(无机试剂任选)。________________________
为原料制备拉西地平的合成路线(无机试剂任选)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)属于“呆矿”,在水中存在如下平衡
K2SO4MgSO42CaSO42H2O(s)2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
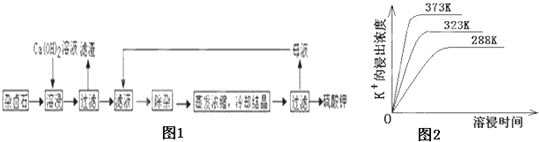
(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+![]() CaCO3(s)+
CaCO3(s)+![]()
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是
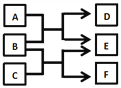
A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。

(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体的结构示意图_____________。
(2)在晶体中,每个Na+的周围与它最接近且距离相等的Na+共有________个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶角上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于________,即________(填计算式);Na+的个数等于________,即________(填计算式)。
(4)设NaCl的摩尔质量为M g/mol,食盐晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,食盐晶体中两个距离最近的钠离子间的距离为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R是合成某高分子材料的单体,其结构简式如图所示。下列说法错误的是
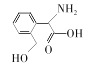
A.R与HOCH2COOH分子中所含官能团完全相同
B.用NaHCO3溶液可检验R中是否含有羧基
C.R能发生加成反应和取代反应
D.R苯环上的一溴代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.1 mol/L醋酸溶液中,存在电离平衡CH3COOH![]() H++CH3COO-。经测定溶液中c(CH3COO―)为1.4×10-3 mol/L,此温度下醋酸的电离平衡常数Ka=________。
H++CH3COO-。经测定溶液中c(CH3COO―)为1.4×10-3 mol/L,此温度下醋酸的电离平衡常数Ka=________。
(2)已知饱和硫化氢的浓度为0.1 mol/L,硫化氢的电离常数为Ka1=1.0×10-7,Ka2=1.0×10-19,计算饱和硫化氢溶液中氢离子的浓度为__________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com