
【题目】(1)0.1 mol/L醋酸溶液中,存在电离平衡CH3COOH![]() H++CH3COO-。经测定溶液中c(CH3COO―)为1.4×10-3 mol/L,此温度下醋酸的电离平衡常数Ka=________。
H++CH3COO-。经测定溶液中c(CH3COO―)为1.4×10-3 mol/L,此温度下醋酸的电离平衡常数Ka=________。
(2)已知饱和硫化氢的浓度为0.1 mol/L,硫化氢的电离常数为Ka1=1.0×10-7,Ka2=1.0×10-19,计算饱和硫化氢溶液中氢离子的浓度为__________mol/L。
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
【题目】某小组为探究K3[Fe(C2O4)3·3H2O(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验。下列有关叙述错误的是( )
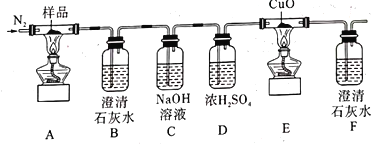
A.通入氮气的目的有;隔绝空气、使反应产生的气体全部进人后续装置
B.实验中观察到装置F中澄清石灰水变浑浊,装置E中固体变为红色,由此可判断热分解产物中一定含有CO2和CO
C.为防止倒吸,停止实验时应进行的操作是:先熄灭装置A、E的酒精灯,冷却后停止通人氮气
D.样品完全分解后,取少许装置A中残留物于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,可证明残留物中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=______________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2 h 的平均反应速率v(H2)=_________________________________;
②该温度下,CO2的平衡转化率为________。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH________0(填“>”或“<”)。
②曲线c表示的物质为_______。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施______________。(答出一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧后的主要产物。
(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-)____________c(Na+)(填“>”“<”或“=”) 。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;键能E(o=o)=499.0 kJ/mol
①CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=____________kJ/mol
CO2(g)+O(g) 的△H=____________kJ/mol
②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足: c(CO)·c(O2)=c(CO2)·c(O),则此时反应____________(填向左”或“向右”)进行。
(3)已知:反应CO2(g)![]() CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)
CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2,
2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2, 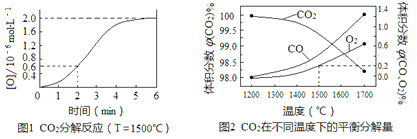
①分析图1,求2min内v(CO2)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K=______(计算结果保留1位小数)。
(4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项 | T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
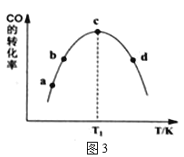
①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A. 使用催化剂CuO-ZnO-ZrO2 B. 适当降低反应温度
C. 增大CO和H2的初始投料比 D. 恒容下,再充入a mol CO和3a mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某废催化剂(含ZnO、CuO、Fe2O3、石墨及MnO2等)中回收金属并制取活性氧化锌的工艺流程如下(已知:Zn及其氧化物、氢氧化物的性质与Al及其相应化合物性质类似):
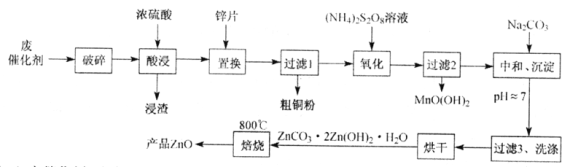
(1)废催化剂“破碎”的目的是____________________________________________。
(2)“氧化”时Mn2+被氧化的离子方程式为_________________________________。
(3)“中和、沉淀”时,若pH过高,则碱式碳酸锌的产率偏小。写出其反应的离子方程式(任写一个即可):____________________________________________。
(4)测得“粗铜粉”中铜的质量分数的实验步骤如下:
I.准确称取粗铜粉mg,加入足量盐酸和H2O2溶液使其完全溶解。
Ⅱ.将溶液煮沸1~2min,除去过量的H2O2。
Ⅲ.滴入铁掩蔽剂排除Fe3+的干扰。然后加入稍过量的KI溶液(反应:2Cu2++4I-=2CuI↓+I2),再加入几滴淀粉溶液作指示剂,用 c mol ·L-1Na2S2O3标准溶液滴定至蓝色消失(I2+2S2O32-=2I-+S4O62-)且半分钟内不变色,共消耗Na2S2O3标准溶液VmL。
①铜的质量分数为______________________。
②缺少步骤Ⅱ哙会使测得的铜的质量分数___________(填“偏大”、“偏小”、或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25°C时,若向a mol·L-1的HA溶液中,滴加等体积的b mol·L-1的NaOH溶液,使溶液呈中性,用含a的代数式表示HA的电离平衡常数Ka=____________。
(2)25°C时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应完后溶液中c(NH4+)=c(Cl-),则溶液显_____性(填“酸”、“碱”或“中”),用含a的代数式表示NH3·H2O的电离平衡常数Kb=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A.含有25.2g HNO3的浓硝酸与足量的铜反应产生的NO2分子数目为0.1NA
B.1L0.6mol/L的Na2CO3溶液中含有的O原子数目为1.8NA
C.标准状况下,22.4L的CH3COOH中含有的H原子个数为4NA
D.反应4NH3+6NO 5N2+6H2O中,当生成140g的N2时转移12NA
5N2+6H2O中,当生成140g的N2时转移12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物H是一种有机高分子材料,其合成路线如图所示:
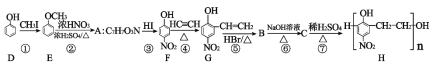
请回答下列问题:
(1)有机物D的名称是__________________,A的结构简式为_____________________;
(2)反应④的反应类型为________________;
(3)有机物F的核磁共振氢谱有____________组峰,峰面积之比为__________________;
(4)C到H的化学方程式为__________________________________________________;
(5)设计步骤①和步骤③的目的是_____________________________________________;
(6)满足下列条件的比G多一个O原子的有机物的同分异构体,有_____________种。
①能够发生银镜反应 ②含有硝基;
③能与FeCl3溶液发生显色反应; ④苯环上有三个取代基;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)![]() 2HI(g)的说法,不正确的是 ( )
2HI(g)的说法,不正确的是 ( )
A.放热反应B.吸热反应C.化合反应D.可逆反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com