
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A.含有25.2g HNO3的浓硝酸与足量的铜反应产生的NO2分子数目为0.1NA
B.1L0.6mol/L的Na2CO3溶液中含有的O原子数目为1.8NA
C.标准状况下,22.4L的CH3COOH中含有的H原子个数为4NA
D.反应4NH3+6NO 5N2+6H2O中,当生成140g的N2时转移12NA
5N2+6H2O中,当生成140g的N2时转移12NA
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
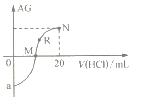
A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.1 mol/L醋酸溶液中,存在电离平衡CH3COOH![]() H++CH3COO-。经测定溶液中c(CH3COO―)为1.4×10-3 mol/L,此温度下醋酸的电离平衡常数Ka=________。
H++CH3COO-。经测定溶液中c(CH3COO―)为1.4×10-3 mol/L,此温度下醋酸的电离平衡常数Ka=________。
(2)已知饱和硫化氢的浓度为0.1 mol/L,硫化氢的电离常数为Ka1=1.0×10-7,Ka2=1.0×10-19,计算饱和硫化氢溶液中氢离子的浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
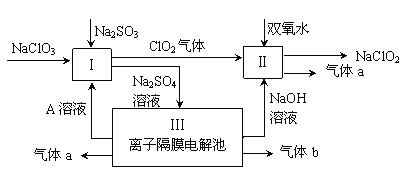
(1)双氧水的结构式为:___________;Ⅰ中发生反应的还原剂是_____(填化学式)。
(2)Ⅱ中反应的离子方程式是_______________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式_______。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因_______________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量_______(填相同、不相同或无法判断)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于电解质溶液中的比值问题说法正确的是
A.pH=11的NaOH和pH=3CH3COOH等体积混合:![]() <1
<1
B.向Ba(OH)2和氨水的混合液中加入盐酸:![]() 增大
增大
C.向CaCO3和CaSO4的悬浊液中加入少量Na2CO3固体:![]() 增大
增大
D.向CH3COONa溶液中加水稀释:![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒可防止人体因氧化而引起的衰老、组织硬化。回答下列问题:
(1)写出基态硒(Se)原子的价电子排布式____________;其中未成对电子数为_________;
(2)砷(As)和硒(Se)的第一电离能较大的是__________________;
(3)SeF2的立体构型为______________,Se原子的杂化方式为____________________;
(4)H2Se和H2O的熔沸点较高的是_________,原因是___________________________;
![]()
(5)Se和Zn组成的某种晶胞如图所示,则该晶体的化学式为________________,若已知该晶胞的密度为ρg/cm3,则该晶胞的棱长a=_______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-![]() H++A2-(25 ℃时Ka=5.0×10-3),下列有关说法中正确的是( )
H++A2-(25 ℃时Ka=5.0×10-3),下列有关说法中正确的是( )
A.H2A是弱酸
B.稀释0.1 mol·L-1 H2A溶液,因电离平衡向右移动而导致c(H+)增大
C.若0.1 mol·L-1 NaHA溶液中c(H+)=0.02 mol·L-1,则0.1 mol·L-1的H2A中c(H+)<0.12 mol·L-1
D.在0.1 mol·L-1的H2A溶液中,c(H+)=0.12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A、B两个恒容密闭容器中发生反应:2NO22NO +O2反应过程中NO2的物质的量随时间变化的状况如图所示:
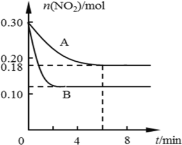
(1)若A容器的体积为5 L,反应经6 min达到平衡状态,则0~6 min内以O2浓度变化表示的反应速率为___________。
(2)该反应化学平衡常数K=__________(写出表达式)。
(3)说明该反应已达到平衡状态的是_______。
A.v正(NO2)=v逆(NO)B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(4)若A、B两容器中只是温度不同,则TA____TB (填“>”或“<”),请写出一条能提高二氧化氮转化率的措施_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com