
【题目】常温下,下列关于电解质溶液中的比值问题说法正确的是
A.pH=11的NaOH和pH=3CH3COOH等体积混合:![]() <1
<1
B.向Ba(OH)2和氨水的混合液中加入盐酸:![]() 增大
增大
C.向CaCO3和CaSO4的悬浊液中加入少量Na2CO3固体:![]() 增大
增大
D.向CH3COONa溶液中加水稀释:![]() 减小
减小
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A.pH值等于5的HCl溶液和PH值等于9的NaOH溶液由水电离出的c(H+)之比为1:1
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.PH=2的HNO3溶液和PH=10的Ba(OH)2溶液等体积混合后的溶液的PH=7
D.向0.1 mol/L的氨水中加入少量醋酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧后的主要产物。
(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-)____________c(Na+)(填“>”“<”或“=”) 。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;键能E(o=o)=499.0 kJ/mol
①CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=____________kJ/mol
CO2(g)+O(g) 的△H=____________kJ/mol
②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足: c(CO)·c(O2)=c(CO2)·c(O),则此时反应____________(填向左”或“向右”)进行。
(3)已知:反应CO2(g)![]() CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)
CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2,
2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2, 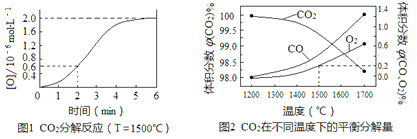
①分析图1,求2min内v(CO2)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K=______(计算结果保留1位小数)。
(4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项 | T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
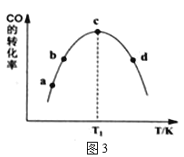
①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A. 使用催化剂CuO-ZnO-ZrO2 B. 适当降低反应温度
C. 增大CO和H2的初始投料比 D. 恒容下,再充入a mol CO和3a mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25°C时,若向a mol·L-1的HA溶液中,滴加等体积的b mol·L-1的NaOH溶液,使溶液呈中性,用含a的代数式表示HA的电离平衡常数Ka=____________。
(2)25°C时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应完后溶液中c(NH4+)=c(Cl-),则溶液显_____性(填“酸”、“碱”或“中”),用含a的代数式表示NH3·H2O的电离平衡常数Kb=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A.含有25.2g HNO3的浓硝酸与足量的铜反应产生的NO2分子数目为0.1NA
B.1L0.6mol/L的Na2CO3溶液中含有的O原子数目为1.8NA
C.标准状况下,22.4L的CH3COOH中含有的H原子个数为4NA
D.反应4NH3+6NO 5N2+6H2O中,当生成140g的N2时转移12NA
5N2+6H2O中,当生成140g的N2时转移12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列关于N及其化合物的问题:
(1)配制Fe(NO3)2溶液时可否加入少量HNO3抑制Fe2+水解?_______,原因是__________________________________________。
(2)汽车尾气中含有大量NO2,会导致环境污染,在汽车尾气管装上电化学转化装置在碱性水溶液环境中形成原电池,可部分解除NO2的污染,则该装置的正极反应方程式为_________________________________;该装置的负极原料为NH3,当电路中转移8mole-时,负极消耗NH3的质量理论值约为________,(保留小数点后一位小数)实际上消耗NH3的量远大于该理论值的原因可能为_________________________________________。
(3)NaOH溶液也可解除NO2的污染,该反应的化学方程式为_____________________________。
(4)第(3)问反应可产生致癌物质NaNO2,该物质中N元素的化合价为_____价,酸性环境中的NaNO2可用H2O2氧化处理,处理过程的离子方程式为___________________,若改用O2来氧化,则68g的H2O2相当于O2的质量为____;(保留小数点后一位小数)使用H2O2作为氧化剂的优点是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物H是一种有机高分子材料,其合成路线如图所示:
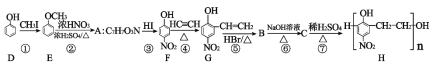
请回答下列问题:
(1)有机物D的名称是__________________,A的结构简式为_____________________;
(2)反应④的反应类型为________________;
(3)有机物F的核磁共振氢谱有____________组峰,峰面积之比为__________________;
(4)C到H的化学方程式为__________________________________________________;
(5)设计步骤①和步骤③的目的是_____________________________________________;
(6)满足下列条件的比G多一个O原子的有机物的同分异构体,有_____________种。
①能够发生银镜反应 ②含有硝基;
③能与FeCl3溶液发生显色反应; ④苯环上有三个取代基;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源,石墨为电极电解CuSO4溶液(足量),装置如下图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是( )
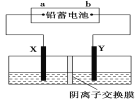
A.a为铅蓄电池的负极
B.电解过程中SO42-向右侧移动
C.电解结束时,左侧溶液质量增重8 g
D.铅蓄电池工作时正极电极反应式为:PbSO4+2e-===Pb+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体![]() 又称摩尔盐,
又称摩尔盐,![]() ,浅绿色能溶于水,在空气中不易被氧化。实验室以废铁屑(含少量硫化物、
,浅绿色能溶于水,在空气中不易被氧化。实验室以废铁屑(含少量硫化物、![]() 、油污等杂质)为料制备硫酸亚铁铵晶体的流程如下:
、油污等杂质)为料制备硫酸亚铁铵晶体的流程如下:
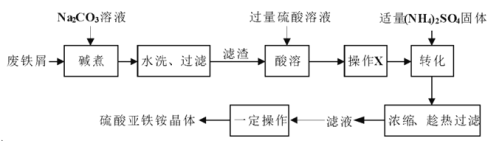
回答下列问题:
(1)“碱煮”的目的是___________。
(2)“酸溶”在如图所示装置中完成(部分装置省略)。仪器![]() 的名称是______,反应过程中有臭鸡蛋气味气体产生,则装置
的名称是______,反应过程中有臭鸡蛋气味气体产生,则装置![]() 的作用是_____________________。
的作用是_____________________。
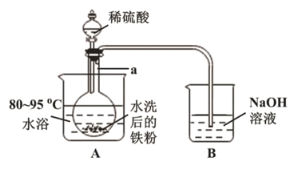
(3)欲检测“酸溶”所得溶液中是否含有![]() ,可选用试剂为_____________,结果表明溶液中不含
,可选用试剂为_____________,结果表明溶液中不含![]() ,原因是______________________。“操作
,原因是______________________。“操作![]() ”是加入铁粉,指出该操作的主要目的是________________。
”是加入铁粉,指出该操作的主要目的是________________。
(4)产品纯度测定:称取![]() 硫酸亚铁铵晶体样品,加入硫酸溶解,用容量瓶配制成
硫酸亚铁铵晶体样品,加入硫酸溶解,用容量瓶配制成![]() 溶液。量取
溶液。量取![]() 所配溶液于锥形瓶中,消耗
所配溶液于锥形瓶中,消耗![]() 酸性
酸性![]() 标准溶液体积为
标准溶液体积为![]() 。
。
①滴定过程反应的离子方程式为_____________。
②产品的纯度为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com