
【题目】求99mL,pH=1的H2SO4与100mLpH=13的NaOH混合后,溶液的pH= ____________
【答案】10.7
【解析】
99mL pH=1的H2SO4溶液n(H+)=0.099L×0.1mol/L=0.0099mol,100mLpH=13的NaOH溶液n(OH-)=0.10L×0.1mol/L=0.01mol,碱过量,反应后溶液呈碱性,依据Kw计算反应后c(H+),可计算pH。
99mL pH=1的H2SO4溶液n(H+)=0.099L×0.1mol/L=0.0099mol,100mLpH=13的NaOH溶液n(OH-)=0.10L×0.1mol/L=0.01mol,碱过量,反应后溶液的体积为99mL+100mL=199mL=0.199L,则反应后c(OH)=![]() ,
,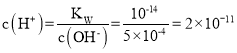 ,pH=lgc(H+)=11lg2=10.7,故答案为:10.7。
,pH=lgc(H+)=11lg2=10.7,故答案为:10.7。


科目:高中化学 来源: 题型:
【题目】下列事实可证明NH3·H2O是弱碱的是( )
A.氨水能与氯化镁反应生成氢氧化镁
B.氨水能与硫酸发生中和反应
C.0.2 mol·L-1氨水与0.2 mol·L-1盐酸等体积混合后,溶液pH约为5
D.氨水可以使酚酞溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①A中盛装氢氧化钠溶液的仪器名称为______________,制取次氯酸钠和氧氧化钠混合液的连接顺序为_______________________(按气流方向,用小写字母表示)。
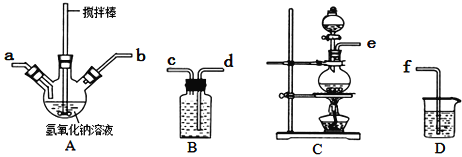
若该实验温度控制不当,反应后测得三颈瓶内ClO与ClO3的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到到另一种溶液中(填“NaClO溶液”或“尿素溶液”),且该溶液应该________滴加。(填“快速”或“不宜过快”)
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
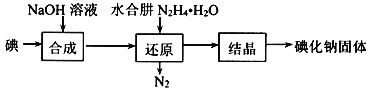
在“还原”过程中,主要消耗反应过程中生成的副产物IO3,该过程的离子方程式为______________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是______________
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L1的Na2S2O3标准溶液滴定至终点(反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝苯地平H是一种治疗高血压的药物;其一种合成路线如下:

已知:酯分子中的a-碳原子上的氢比较活泼,使酯与酯之间能发生缩合反应。
![]()
回答下列问题:
(1)B的化学名称为________.
(2)②的反应类型是________.
(3)D的结构简式为________.
(4)H的分子式为________.
(5)反应①的化学方程式为________.
(6)已知M与G互为同分异构体,M在一定条体下能发生银镜反应,核磁共振氢谱显示有4组峰,峰面积之比为1:1:2:4,写出M的一种可能的结构简式________.
(7)拉西地平 也是一种治疗高血压药物,设以乙醇和
也是一种治疗高血压药物,设以乙醇和 为原料制备拉西地平的合成路线(无机试剂任选)。________________________
为原料制备拉西地平的合成路线(无机试剂任选)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与体积(V)的关系如图所示,则下列说法正确的是( )
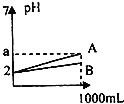
A.A、B两种酸溶液物质的量浓度一定相等
B.若a=5,则A是强酸,B是弱酸
C.稀释后A酸溶液的酸性比B酸溶液强
D.若a<5,则A.B都是弱酸且A的酸性>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)属于“呆矿”,在水中存在如下平衡
K2SO4MgSO42CaSO42H2O(s)2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
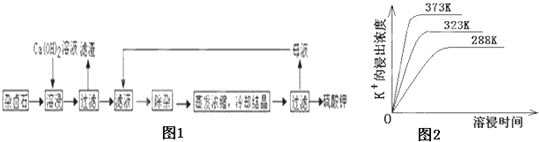
(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+![]() CaCO3(s)+
CaCO3(s)+![]()
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是
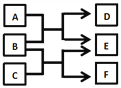
A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
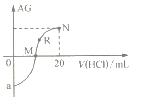
A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com