
【题目】一种全天候太阳能电池光照时的工作原理如图所示。
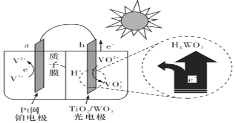
下列说法不正确的是( )
A.硅太阳能电池供电原理与该电池相同
B.光照时,b极的电极反应式为VO2+﹣e-+H2O=VO2++2H+
C.光照时,毎转移1mol电子,有2molH+由b极区经质子交换膜向a极区迁移
D.夜间时,该电池相当于蓄电池放电,a极发生氧化反应
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B.5.8g熟石膏(2CaSO4 H2O)含有的结晶水分子数为0.02NA
C.4.6g C2H6O中含C-H键数为0.6NA
D.1L甲醛气体完全燃烧消耗O2的数目约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与体积(V)的关系如图所示,则下列说法正确的是( )
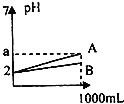
A.A、B两种酸溶液物质的量浓度一定相等
B.若a=5,则A是强酸,B是弱酸
C.稀释后A酸溶液的酸性比B酸溶液强
D.若a<5,则A.B都是弱酸且A的酸性>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是
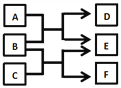
A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
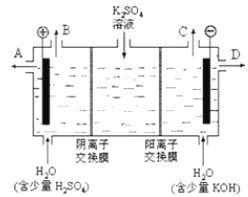
(1)该电解槽的阳极反应为________________________,此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2) 制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”、“D”)导出,制得的氧气从出口________ (填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________ 。
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
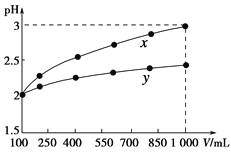
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是________________,离子化合物YX5的电子式是_________。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是________个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐)。A晶体的晶胞为正方体(如图)。
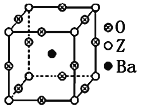
①制备A的化学方程式是_________________________________________;
②在A晶体中,Z的配位数为_______________;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的______________。
(4)R2+离子的外围电子层电子排布式为______________。R2O的熔点比R2S的________(填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶胞为正方体(如图),若晶胞棱长为540.0 pm,则晶胞密度为___________________________g·cm3(列式并计算)。
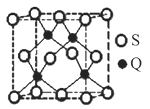 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
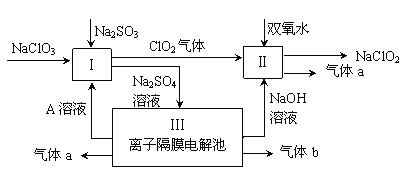
(1)双氧水的结构式为:___________;Ⅰ中发生反应的还原剂是_____(填化学式)。
(2)Ⅱ中反应的离子方程式是_______________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式_______。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因_______________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量_______(填相同、不相同或无法判断)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com