
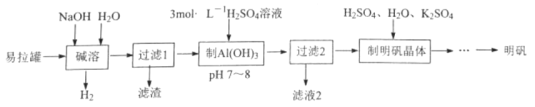
【题目】用废易拉罐(主要成分为Al,少量Fe等)制取明矾的实验流程如下:
(1)铝位于周期表第________周期________族。
(2)检验明矾中K+的方案是:用洁净的铂丝蘸取明矾少许,在酒精灯火焰上灼烧,_______,说明含有K+。
(3)配制100mL 3mol·L-1H2SO4溶液所需的玻璃仪器有:量筒、烧杯、玻璃棒、______和_____。
(4)写出“碱溶”时铝转化为偏铝酸钠的离子方程式: ___________。
【答案】三 IIIA 通过蓝色钴玻璃观察,若有紫色火焰产生 100mL的容量瓶 胶头滴管 2Al+2H2O+2OH-=2![]() +3H2↑
+3H2↑
【解析】
铝和氢氧化钠反应生成偏铝酸钠和氢气,向偏铝酸钠溶液中加入硫酸调节pH为7~8,偏铝酸钠生成氢氧化铝沉淀,向氢氧化铝中加硫酸、硫酸钾溶液,蒸发结晶得到明矾。
(1)铝是13号元素,铝原子有3个电子层、最外层有3个电子,铝位于周期表第三周期IIIA族;
(2)钾的焰色为紫色,检验明矾中K+的方案是:用洁净的铂丝蘸取明矾少许,在酒精灯火焰上灼烧,通过蓝色钴玻璃观察,若有紫色火焰产生,说明含有K+;
(3)配制100mL 3mol·L-1H2SO4溶液,计算需要浓硫酸体积后,用量筒量取所需要体积的浓硫酸,在烧杯中稀释,用玻璃棒不断搅拌,冷却后将溶液用玻璃棒引流转移到100mL容量瓶中,洗涤烧杯和玻璃棒2-3次,洗涤液全部转移到容量瓶,定容时,液面离刻度线1~2cm时用胶头滴管逐滴滴加到凹液面最低处与刻度线相切,摇匀后装瓶,所以用到的玻璃仪器:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管。
(4) “碱溶”时铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2H2O+2OH-=2![]() +3H2↑;
+3H2↑;


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答
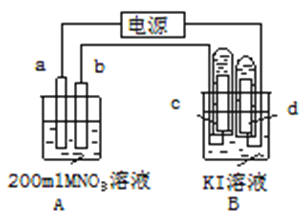
(1)a连接电源的__________极。b极的电极反应式为______________________________。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:_______________,电解进行一段时间后,罩在C极上的试管中也收集到了气体。此时C极上的电极反应式为________________________________
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了__________mol气体,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为___________。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL。取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全。试计算电解前A烧杯中MNO3溶液的物质的量浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL含有0.1molCl2的氯水中滴加2mol·L1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
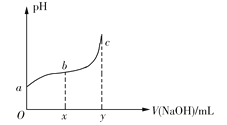
A.若a点pH=4,且c(Cl)=mc(HClO),则HClO的电离平衡常数为![]()
B.若x=100,b点对应溶液中,c(OH)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中,c(OH)c(H+)=2c(Cl)+c(HClO)
D.b→c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和②B. ②和④C. ③和④D. ①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是氧化性酸,其本质是NO![]() 有氧化性,某课外实验小组进行了下列有关NO
有氧化性,某课外实验小组进行了下列有关NO![]() 氧化性的探究(实验均在通风橱中完成)。
氧化性的探究(实验均在通风橱中完成)。
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
实验Ⅱ | 15mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
⑴写出铜与稀硝酸反应的离子方程式_____。
⑵实验Ⅰ中,铝片作_____(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是_____。
⑶实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是______。
查阅资料:活泼金属与1mol·L-1稀硝酸反应有H2和NH![]() 生成,NH
生成,NH![]() 生成的原理是产生H2的过程中NO
生成的原理是产生H2的过程中NO![]() 被还原。
被还原。
⑷用如图装置进行实验Ⅲ:溶液X为1mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。反应后的溶液中含NH![]() 。生成NH
。生成NH![]() 的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
⑸进一步探究碱性条件下NO![]() 的氧化性,进行实验Ⅳ(如图):
的氧化性,进行实验Ⅳ(如图):
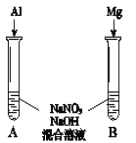
①观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的原因是_____。
②A中生成NH3的离子方程式是______。
⑹将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的结构陶瓷材料,可用作LED的基质材料,通过等离子法由SiH4(沸点-111.9℃)与氨气反应制取的方程式如下:3SiH4+4NH3=Si3N4+12H2。设NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1.8gSiH4所含质子的数目为3.2NA
B.标准状况下,4.48LNH3和H2的混合气体所含分子总数为0.2NA
C.NA个NH3分子溶于1L的水,所得溶液的物质的量浓度为1mol·L-1
D.当生成1molSi3N4时,转移电子数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO3(g)![]() 2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
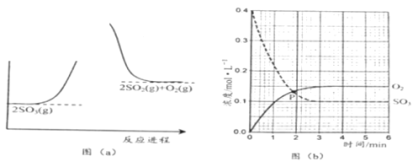
A.由图(a) 知,正反应为放热反应
B.图(b)中,SO3分解的平均速率0~1min比1~2min慢
C.图(b)中,P点时反应达到平衡状态
D.由图(b)知,SO2的平衡浓度为0.3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),达到平衡时,生成了2mol C,经测定,D的浓度为0.5mol·L-1,下列判断正确的是( )
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com