
【题目】425℃时,在两个1L密闭容器中分别发生化学反应,物质的浓度随时间的变化如图所示。下列叙述错误的是( )
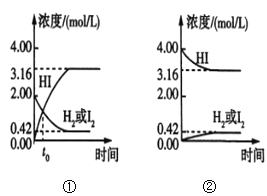
A.图①中t0时,三种物质的物质的量相等
B.图①中t0时,反应未达到平衡状态
C.图①②中,当c(HI)=3.16mol/L时,两容器中的反应均达到平衡状态
D.混合气体的密度不再发生变化可以作为达到平衡状态的标志
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________(填“吸热”或“放热”)反应,其能量变化可用图中的____________(填“B”或“C”)表示。

(2)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应___________(填“放出”或“吸收”)________kJ 的热量。
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应_____________________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列7种化学符号:18O;14C;23Na;14N;32S;16O;1H2
(1)表示核素的符号共______种。
(2)互为同位素的是______和______。
(3)质量数相等,但不能互为同位素的是______和______。
(4)中子数相等,但质子数不相等的是______和______。
II.(1)写出下列物质的电子式: NH3 _____________, CO2______。
(2)2.2g铵根![]() 的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 17个质子,20个中子,核外有18个电子,该粒子的化学符号是____。
的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 17个质子,20个中子,核外有18个电子,该粒子的化学符号是____。
(3)已知断开 1mol H—H 键、1mol I—I 键、1mol H—I 键分别需要吸收的能量为 436kJ、151kJ、299kJ,则由 1mol H2和 1mol I2生成 2mol HI会_____(“放出”或“吸收”)_____kJ 的热量。
(4)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S,只由离子键构成的物质是_____(填序号,下同),由离子键和非极性共价键构成的物质是________,属于共价化合物的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:


已知以下信息:

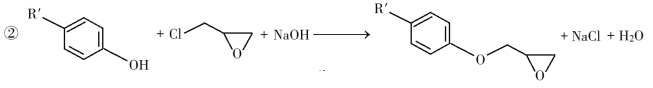
 回答下列问题:
回答下列问题:
(1)A是一种烯烃,化学名称为__________,C中官能团的名称为__________、__________。
(2)由B生成C的反应类型为__________。
(3)由C生成D的反应方程式为__________。
(4)E的结构简式为__________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式__________、__________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765g,则G的n值理论上应等于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为:![]() 。下列说法错误的是
。下列说法错误的是
A.上述反应属于加成反应
B.碳酸亚乙酯的二氯代物只有两种
C.碳酸亚乙酯中的所有原子处于同一平面内
D.1mol碳酸亚乙酯最多可消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:

回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。

(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。

①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(Na2S)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为___________,与粗硒中铁含量为0.89%相比,铁含量明显降低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如下图所示:
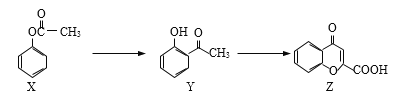
下列有关叙述正确的是
A. 三种物质中都含有羰基
B. 等物质的量的Y、Z能和含有等物质的量的NaOH的溶液反应
C. 可用NaHCO3溶液鉴别三种物质
D. 1 mol Z跟足量O2反应,最多消耗10 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国研究锂硫电池获得突破,电池的总反应是16Li+S8 ![]() 8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
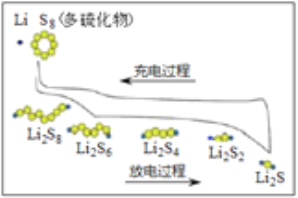
A. 充电时,电能转化为化学能
B. 放电时,锂离子向正极移动
C. 放电时,1mol Li2S6转化为Li2S4得到2mole-
D. 充电时,阳极总电极反应式是8S2- -16e- = S8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
IA | 0 | |||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是_________,其氢化物的电子式是_________。
(3)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(4)主族元素砷(As)的部分信息如图所示。

①砷(As)在周期表中的位置是______。
②下列说法正确的是_______(填序号)。
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.③的气态氢化物的还原性大于砷的气态氢化物的还原性
(5)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。已知:常温下浓盐酸与高锰酸钾反应生成氯气。
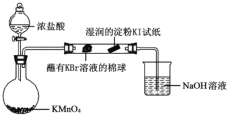
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br >I,并说明理由_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com