
【题目】某研究性学习小组设计实验用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率。已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质。有关数据如下:
熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |
(1)制备乙烯

① 从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为________(填仪器接口的字母编号)。
② D装置中发生反应的离子方程式_____________实验后,检验D溶液中含有CO32-的实验方案为______________。
③ E装置的主要作用是__________________。
(2)测定乙烯
反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4。
已知:C2H4 ![]() CO2+H2O;C2O42-
CO2+H2O;C2O42- ![]() CO2+H2O;MnO4-→Mn2+
CO2+H2O;MnO4-→Mn2+
④ 以下情况使得测定乙烯的量偏高的是(_____)
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤ 油定终点的现象为_______________。
⑥ 已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为___________。
【答案】 a→h i→f g→d SO2 + 2OH—=SO32— + H2O 、CO2 + 2OH—=CO32— + H2O 取少许D溶液于试管中,先滴加足量的双氧水,然后再加入一定量的硫酸,产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32— 冷凝并收集乙醚 CD 溶液由粉红色变成无色,且半分钟内不变色。 2.91%
【解析】试题分析:本题以乙醇的消去反应生成乙烯为背景,考查化学反应方程式书写、离子检验方案设计、装置选择的原理、定量实验方案中误差的讨论、滴定终点的判断、定量实验计算等知识,考查考生的实验设计能力和对定量实验的综合分析能力。解答过程中需要充分阅读、理解题目的已知条件,并且合理应用到解题过程中。
解析:(1)①由于乙醇转变成乙烯的气体中同时含有SO2、CO2、乙醇和乙醚等杂质,而待选择的装置中只有酸性KMnO4溶液可以吸收乙烯用于定量测定,但是酸性KMnO4能同时氧化乙醇、SO2,这样就会使得测定结果出现较大误差,所以必须先除去这些杂质。结合题目中乙醇、乙醚性质的描述,可选择冰水冷却使乙醇、乙醚液化,选择NaOH溶液除去SO2、CO2。正确答案:a→h i→f g→d。②D装置中的NaOH吸收SO2、CO2,反应的离子方程式是 SO2+2OH-=SO32-+H2O 、CO2+2OH-=CO32-+H2O。检验其中的CO32-时,常用的方法是用酸反应产生CO2或用CaCl2等反应生成CaCO3沉淀,但是两种方案中SO32-都会影响CO32-的检验,必须先除去,考虑到不能干扰CO32-检验,可以将SO32-氧化除去。正确答案:SO2+2OH-=SO32-+H2O CO2+2OH-=CO32-+H2O、取少许D溶液于试管中,先滴加足量的双氧水,然后再加入一定量的硫酸,产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32- 。③ E装置的冰水可以冷凝除去乙醇、乙醚,正确答案:冷凝并收集乙醚和乙醇。(2)除去杂质后,乙烯在酸性KMnO4溶液中氧化生成CO2,还原产物是Mn2+,剩余的KMnO4用稀硫酸酸化后用Na2C2O4滴定,Na2C2O4溶液水解呈碱性,需盛放在见识滴定管中。④A、蒸馏水清洗碱式滴定管后直接装Na2C2O4标准液,残留的水会使标准Na2C2O4溶液稀释,导致滴定消耗的Na2C2O4溶液体积偏大,计算得到剩余的KMnO4偏多,与乙烯反应的KMnO4偏少,结果偏小,A错误。B、锥形瓶清洗后残留的水不影响标准Na2C2O4溶液的消耗量,对实验结果无影响,B错误。C、滴定前无气泡,滴定后有气泡,滴定结束读数时,气泡被当成标准溶液体积读数,导致计算时带入的标准液体积偏小,计算得到剩余的KMnO4偏小,与乙烯反应的KMnO4偏多,结果偏大,C正确。D、滴定前平视,滴定后俯视,读出的标准液消耗体积偏小,类似C后半段分析,结果偏大,D正确。正确答案CD。⑤滴定过程中不断消耗KMnO4,所以终点时KMnO4恰好完全反应。正确答案:溶液由粉红色变成无色,且半分钟内不变色。⑥KMnO4与Na2C2O4反应离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,反应消耗20.00mLNa2C2O4时,参加反应的MnO4-: ![]() ,原吸收液吸收乙烯时消耗KMnO4:n(MnO4-)=0.1000mol/L×0.2000L-8×10-4mol×10=0.01200mol,吸收乙烯反应为5C2H4+12MnO4-+36H+=10CO2↑+12Mn2++28H2O,则
,原吸收液吸收乙烯时消耗KMnO4:n(MnO4-)=0.1000mol/L×0.2000L-8×10-4mol×10=0.01200mol,吸收乙烯反应为5C2H4+12MnO4-+36H+=10CO2↑+12Mn2++28H2O,则![]() ,乙醇质量m=0.79g/mL×10mL=7.9g,n(乙醇)=7.9g/46gmol-1=0.1717mol,理论生成乙烯0.1717mol,乙醇转化成乙烯的转化率为0.005000mol/0.1717mol×100%=2.912%。正确答案:2.912%(2.91%也可以)。
,乙醇质量m=0.79g/mL×10mL=7.9g,n(乙醇)=7.9g/46gmol-1=0.1717mol,理论生成乙烯0.1717mol,乙醇转化成乙烯的转化率为0.005000mol/0.1717mol×100%=2.912%。正确答案:2.912%(2.91%也可以)。


科目:高中化学 来源: 题型:
【题目】含有弱酸HA及其钠盐NaA的混合溶液,在化学上可用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)现将0.04 mol·L-1HA溶液和0.02 mol·L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,则该溶液显碱性,该溶液显碱性的原因是___________________,溶液中c(Na+)__________c(CN-)(填“<”、“=”或“>”),你得出该结论的依据是________________________。
②若HA为CH3COOH,则该溶液显酸性。溶液中所有的离子按浓度由大到小排列为_______________________。
(2)Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液。下列有关该缓冲溶液的说法或关系式错误的是__________。
A.加入少量强碱,发生反应:HPO![]() +OH-===PO
+OH-===PO![]() +H2O
+H2O
B.加入少量强酸,发生反应:HPO![]() +H+===H2PO
+H+===H2PO![]()
C.c(Na+)+c(H+)=c(OH-)+c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )
)
D. ![]() c(Na+)>c(PO
c(Na+)>c(PO![]() )+c(HPO
)+c(HPO![]() )+c(H2PO
)+c(H2PO![]() )+c(H3PO4)>
)+c(H3PO4)> ![]() c(Na+)
c(Na+)
(3)一定浓度的NaHCO3和Na2CO3的混合溶液也是一种缓冲溶液,写出在这种溶液中加入少量NaOH或盐酸时发生反应的离子方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.苯与浓溴水反应制取溴苯
C.向浓溴水中加几滴稀苯酚溶液观察沉淀
D.1 mol·L-1CuSO4溶液2 mL和0.5 mol·L-1NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q都是短周期主族元素,其中Z原子的最高正价与最低负价的代数和为4;X与Z同族,Y与X同周期,Q原子的电子总数等于其电子层数的3倍,W与Y、Z不同周期;X、Y、Z三种元素的族序数之和为17。
(1)Z的简单离子结构示意图为__________________。
(2)写出含有10个中子的X原子的核素符号_____________。
(3)红热的Q单质可以与Z的最高价氧化物的水化物的浓溶液反应,写出该反应的化学方程式___________________。
(4)Y的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式____________。
(5)X和Z两种元素相比较,非金属性较强的是(填元素名称)_______,可以验证该结论的是______(填写编号);
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)下列关于土述元素说法正确的是_________。
A.X、Y、Q都能与W形成10电子分子
B.Y的最高价氧化物对应水化物能与Y的简单氢化物反应生成盐
C.X可以分别与另外四种元素最多各形成两种氧化物
(7) Na在X2中燃烧所得产物的化学式是_______,该物质中存在的化学键类型有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的密闭容器中,发生3A(g)+B(g)2C(g)的反应,若最初加入A和B都是4mol,1min内,测得υ(A)=1.2mol·L﹣1·min﹣1,则此时容器中B的物质的量是
A. 1.6mol B. 2.8mol C. 3.2mol D. 3.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们用DNA制造出一种臂长只有7nm的纳米镊子,这种镊子能钳起分子或原子,并对它随意组合.下列分散系中,分散质微粒直径与纳米粒具有相同数量级的是( )
A.溶液
B.胶体
C.悬浊液
D.乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图。下列说法正确的是( )
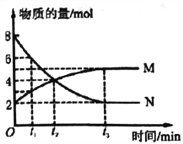
A. M、N之间转化的反应方程式为M =2N
B. t2时刻,反应达到平衡,正、逆反应速率达到相等
C. t3时刻,M的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
D. t1时刻,在容器内气体M和N的物质的量浓度之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com