
【题目】X、Y、Z、W、Q都是短周期主族元素,其中Z原子的最高正价与最低负价的代数和为4;X与Z同族,Y与X同周期,Q原子的电子总数等于其电子层数的3倍,W与Y、Z不同周期;X、Y、Z三种元素的族序数之和为17。
(1)Z的简单离子结构示意图为__________________。
(2)写出含有10个中子的X原子的核素符号_____________。
(3)红热的Q单质可以与Z的最高价氧化物的水化物的浓溶液反应,写出该反应的化学方程式___________________。
(4)Y的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式____________。
(5)X和Z两种元素相比较,非金属性较强的是(填元素名称)_______,可以验证该结论的是______(填写编号);
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)下列关于土述元素说法正确的是_________。
A.X、Y、Q都能与W形成10电子分子
B.Y的最高价氧化物对应水化物能与Y的简单氢化物反应生成盐
C.X可以分别与另外四种元素最多各形成两种氧化物
(7) Na在X2中燃烧所得产物的化学式是_______,该物质中存在的化学键类型有__________。
【答案】 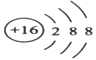
![]() C+2H2SO4(浓)
C+2H2SO4(浓)![]() 2SO2↑ +CO2↑+2H2O
2SO2↑ +CO2↑+2H2O 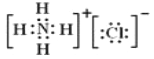 氧 bc AB Na2O2 离子键、共价键(非极性键)
氧 bc AB Na2O2 离子键、共价键(非极性键)
【解析】Z为短周期主族元素,且Z原子的最高正价与最低负价的代数和为4,可知Z的最高价为+6价,即Z为S元素;X与Z同族,则X为O元素;Q原子的电子总数等于其电子层数的3倍,则Q为C元素;W与Y、Z不同周期,则W为H元素;Y与O元素同周期,O、Y、S三种元素的族序数之和为17,则Y为N元素;
(1)S的核电荷数为16,S2-的结构示意图为![]() ;
;
(2)O的核电荷数为8,含有10个中子的X原子的质量数为18,其核素符号为![]() ;
;
(3)红热的C溶解于浓硫酸生成CO2和SO2,则该反应的化学方程式为C+2H2SO4(浓)![]() 2SO2↑ +CO2↑+2H2O;
2SO2↑ +CO2↑+2H2O;
(4)NH3与HC1在空气中相遇有白烟生成,此白烟为NH4Cl晶体,其电子式为![]() ;
;
(5)S和O同主族,核电数越大,非金属性越弱,则非金属性较强的是氧元素,可以通过与氢气化合的难易及生成物的稳定性来验证,故答案为bc;
(6)A.O、N、C都能与H形成10电子分子,分别是H2O、NH3、CH4,故A正确;B.HNO3和NH3可以生成NH4NO3,其为离子化合物,故B正确;C.O元素和N元素可以组成多种氧化物,如N2O、NO、N2O3、NO2、N2O5和N2O4等,故C错误;答案为AB;
(7) Na在O2中燃烧生成Na2O2,该物质中存在的化学键类型有离子键、共价键(非极性键)。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有18个电子,相关信息如下表所示(“/”表示相应的信息略去):
化合物 | X | Y | Z |
分子中含有的原子个数 | / | 4 | / |
摩尔质量/g·mol-1 | 32 | 34 | / |
回答下列问题:
(1)X常用作火箭推进剂,其分子的球棍模型为![]() 则X的化学式为________。
则X的化学式为________。
(2)Y的化学性质描述正确的是________。
a.不稳定性 b.弱碱性
c.氧化性 d.还原性
(3)Z的化学式可用H2A表示。将一定量的Z气体通入0.05 mol·L-1CuSO4溶液中,二者恰好完全反应。已知Ksp(CuA)=6.0×10-36。若不考虑溶液体积的变化,则:
①反应后溶液的pH=________。
②若反应后溶液中c(A2-)=2.0×10-30mol·L-1,则溶液中c(Cu2+)=________mol·L-1。
(4)将一定量的Z气体通入NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。

①0点溶液中所含溶质的化学式为____________。
②已知a点溶液呈碱性,该溶液中离子浓度大小顺序为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下将35 mL气态烷烃完全燃烧,恢复到原来状况下,得到二氧化碳气体140 mL,则该烃的分子式为
A.C5H12 B.C4H10 C.C3H6 D.C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按酸、碱、盐分类顺次排列.正确的是( )
A.硫酸、纯碱、碳酸钙
B.硝酸、烧碱、食盐
C.冰醋酸、纯碱、醋酸钠
D.盐酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中含Cl﹣1.5mol,K+和Na+共1.5mol,Mg2+为0.5mol,则SO42﹣的物质的量为( )
A.1 mol
B.0.5 mol
C.0.25 mol
D.0.15 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率。已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质。有关数据如下:
熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |
(1)制备乙烯

① 从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为________(填仪器接口的字母编号)。
② D装置中发生反应的离子方程式_____________实验后,检验D溶液中含有CO32-的实验方案为______________。
③ E装置的主要作用是__________________。
(2)测定乙烯
反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4。
已知:C2H4 ![]() CO2+H2O;C2O42-
CO2+H2O;C2O42- ![]() CO2+H2O;MnO4-→Mn2+
CO2+H2O;MnO4-→Mn2+
④ 以下情况使得测定乙烯的量偏高的是(_____)
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤ 油定终点的现象为_______________。
⑥ 已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知aAm+与bBn﹣具有相同的核外电子排布,则下列关系正确的是( )
A.a=b+m+n
B.a=b﹣m+n
C.a=b+m﹣n
D.a=b﹣m﹣n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1molH2O的质量为18g/mol
B.标准状况下,1mol任何物质体积均为22.4L
C.CH4的摩尔质量为16g
D.3.01×1023个SO2分子的质量为32g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com