
【题目】已知:废液中含+6 价铬的化合物毒性较大污染性强,常用 NaHSO3 将废液中的Cr2O72-还原成 Cr3+。请配平该反应的离子方程式:_____ Cr2O72-+_____HSO3-+____H+ = ____Cr3++_____SO42-+_____H2O
并用双线桥标出电子转移的方向和数目____________________。
【答案】1 3 5 2 3 4 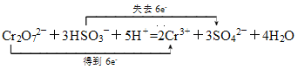
【解析】
在反应Cr2O72-+HSO3-+H+→ Cr3++SO42-+H2O中,Cr2O72-是氧化剂,HSO3-是还原剂;然后确定化合价降低和升高元素的价态变化,按化合价升高与降低总数相等的原则,配平氧化剂和还原剂,进而配平氧化产物和还原产物;再按电荷守恒、质量守恒配平其它物质;用双线桥标出电子转移的方向和数目时,应使用两条带箭头的曲线,一条从反应中的Cr出发,箭头指向生成物中的Cr,另一条从反应物中的S出发,箭头指向产物中的S。
在反应Cr2O72-+HSO3-+H+→ Cr3++SO42-+H2O中,Cr2O72-是氧化剂,HSO3-是还原剂;Cr2O72-中的Cr元素,由+6价降为+3价,Cr2O72-中Cr共降低6价;HSO3-中的S元素,由+4价升为+6价,升高2价。按化合价升高和降低的总数相等的原则配平,二者的化学计量数应为1和3,即Cr2O72-+3HSO3-,由此可确定部分产物的化学计量数,即2Cr3++3SO42-,从而得出Cr2O72-+3HSO3-+H+→ 2Cr3++3SO42-+H2O;再按电荷守恒进行配平,即得Cr2O72-+3HSO3-+5H+→ 2Cr3++3SO42-+H2O;最后按质量守恒进行配平,即得Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O。用双线桥标出电子转移的方向和数目为: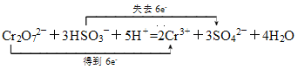 ;
;
答案为:1;3;5;2;3;4;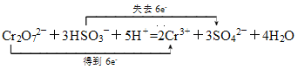 。
。


科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol·L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
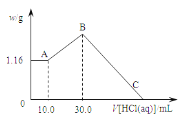
试回答:
(1)A点沉淀的化学式为______。
(2)写出A点至B点发生反应的离子方程式_______。
(3)求原混合物中AlCl3的质量____和NaOH的物质的量____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下: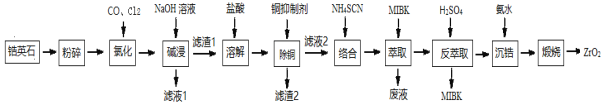
已知:①锆英石中锆元素的化合价为+4 ,“氯化”过程中除C、O元素外,其他元素均转化为最高价氯化物 ②SiCl4极易水解;ZrCl4易溶于水 ③Fe(SCN)3难溶于有机溶剂MIBK; Zr(SCN)4在水中溶解度不大,易溶于有机溶剂MIBK。
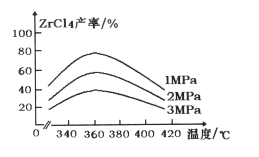
(1) “氯化”过程中,锆英石发生的主要反应的化学方程式为:______________________________,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_____________;
(2)“滤液1”中含有的阴离子除OH- 、Cl-,还有___________________;
(3)常用的铜抑制剂有Na2S、H2S、NaCN等,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________。
(4)实验室进行萃取和反萃取的玻璃仪器是_______。流程中萃取与反萃取的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如下图所示,下列说法正确的是( )
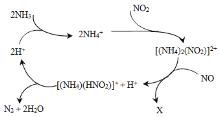
A.X是N2
B.汽车尾气中含有的氮氧化合物是由于汽油燃烧产生的
C.NH4+中含有非极性共价键
D.上述历程的总反应为:2NH3+NO +NO2 2N2+3H2O
2N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
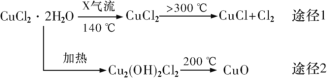
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组在实验室用如下图所示的装置进行实验,验证氨的某些性质并收集少量纯净的N2。
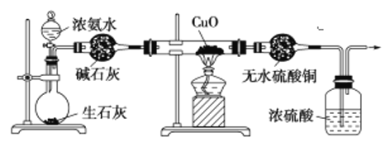
请回答:
(1)实验前先将仪器按图示连接好,然后检查装置的气密性。怎样检查该装置的气密性?________________。
(2)烧瓶内装有生石灰,随浓氨水的滴入,产生氨气。氨气产生的原因是________________。
(3)实验进行一段时间后,观察到加热的硬质玻璃管内的黑色氧化铜粉末变为红色,盛无水CuSO4的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,写出硬质玻璃管内发生反应的化学方程式:______________________。这个反应说明氨气具有________。
A.碱性 B.还原性 C.氧化性 D.不稳定性
(4)洗气瓶中浓硫酸的主要作用是________________________。
(5)在最后出气管的导管口收集干燥、纯净的氮气,收集方法是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中间体M(2—甲基丙氨酸)的结构简式如图所示。下列有关M的说法错误的是

A.分子式为![]()
B.1molM与NaOH溶液反应,消耗lmolNaOH
C.分子中所有的碳原子不可能处于同一平面
D.与M含有相同官能团的同分异构体有5种![]() 不含本身,不考虑空间异构
不含本身,不考虑空间异构![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com