
【题目】将浓度为0.1 mol/L HF溶液加水不断稀释,下列各量始终保持增大的是( )
A. c(H+) B. Ka(HF) C. c(F-) D. c(H+)/c(HF)
【答案】D
【解析】
A.将浓度为0.1 mol/L HF溶液加水不断稀释,酸性减弱;
B.电离平衡常数只与温度有关;
C. 将浓度为0.1 mol/L HF溶液加水不断稀释,c(F-)减小;
D.加水稀释后,氢离子、HF分子均减少相同的倍数,但加水稀释会促进HF的电离,所以HF的浓度减小的更多。
将浓度为0.1 mol/L HF溶液加水不断稀释,酸性减弱,c(H+)减小,故不选A;
B.电离平衡常数只与温度有关,将浓度为0.1 mol/L HF溶液加水不断稀释,Ka(HF)不变,故不选B;
C. 将浓度为0.1 mol/L HF溶液加水不断稀释,c(F-)减小,故不选C;
D.加水稀释后,氢离子、HF分子均减少相同的倍数,但加水稀释会促进HF的电离,所以HF的浓度减小的更多,所以![]() 值增大,故选D。
值增大,故选D。


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ |
(1)写出下列元素的元素符号: ④_________、⑧ __________(填具体元素符号,下同);⑤正一价阳离子的结构示意图是________________。
(2)最高价氧化物是两性氧化物的元素是___________;它的最高价氧化物对应水化物与⑤的最高价氧化物对应水化物溶液反应的离子方程式为_______________________________。
(3)①、②两元素形成的最简单化合物的结构式为________________________,该化合物是由_________(填“极性”“非极性”)键形成的。
(4)④⑦二种元素中非金属性强的是___________。
(5)检验元素⑨的方法是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 mLAl2(SO4)3溶液中,含Al3+1.62 g,在该溶液中加入0.1molL﹣1Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
A. 0.4molL﹣1B. 0.3molL﹣1C. 0.2molL﹣1D. 0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2+3H2![]() 2NH3为放热反应,对该反应的下列说法中正确的是
2NH3为放热反应,对该反应的下列说法中正确的是
A.N2的能量一定高于NH3
B.H2的能量一定高于NH3
C.N2和H2的总能量一定高于NH3的总能量
D.因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铁棒和碳棒在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断正确的是

A.电池工作的过程中,c电极上产生气泡
B.电池工作时,溶液中H+和Fe2+向d移动
C.d为负极,发生氧化反应
D.电池工作的过程中,溶液中SO![]() 浓度发生显著变化
浓度发生显著变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种金属晶体:Na、Zn、Po、Au,如图所示为金属原子的四种基本堆积模型。请回答以下问题:

(1)堆积方式的空间利用率最低的基本堆积模型是___(填编号),符合该堆积模型的金属晶体是______(填化学符号)。
(2)金属原子在二维平面里放置得到密置层和非密置层,其中非密置层的配位数是_____,由非密置层互相错位堆积而成的基本堆积模型是_____(填编号),符合该堆积模型的金属晶体是_____(填化学符号)。
(3)按ABCABCABC……方式堆积的基本堆积模型是____(填编号),符合该堆积模型的金属晶体是______(填化学符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的电解冶炼法,如图所示。以含少量CaC12的CaO熔融物作为介质,电解时阴极生成的Ca进一步还原TiO2得到钛。下列说法不正确的是
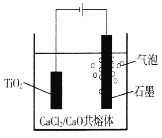
A. Ca还原TiO2的化学方程式为2Ca+TiO2===Ti+2CaO
B. 阳极石墨稳定性强,在实际生产过程中质量几乎不会改变
C. CaC12的作用可能是增强导电性,同时起到助熔剂的作用
D. 已知F=96500C·mol-1,当I=0.5A,通电80分钟,理论上可得Ti的质量为(0.5×80×60×48)/4×96500g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fritz Haber在合成氨领域的贡献距今已经110周年,氮族元素及其化合物应用广泛。
(1)在基态13N原子中,核外存在__________对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为__________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是________,与NO3-互为等电子体的分子为__________。液氨中存在电离平衡2NH3![]() NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
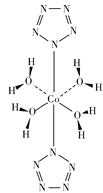
(3)我国科学工作者实现世界首次全氮阴离子(N5-)金属盐Co(N5)2(H2O)4·4H2O的合成,其结构如图所示,可知N5-的化学键类型有______________。
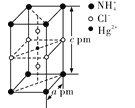
(4)把特定物质的量之比的NH4Cl和HgCl2在密封管中一起加热时,生成晶体X,其晶胞的结构图及晶胞参数如图所示。则晶体X的化学式为__________,其晶体密度为__________(设阿伏加德罗常数的值为NA,列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两个装置的烧杯中分别盛有足量的CuCl2溶液。
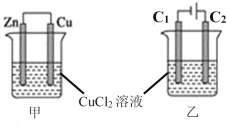
(1)甲装置中,Zn电极发生______反应(填“氧化”或“还原”),溶液中Cl-向_____极(填“Zn”或“Cu”)移动,Zn电极反应式为_______,若反应过程中有0.1mol电子发生转移,则Cu极质量增加__________。
(2)乙装置中,石墨电极C1是_______极,现象是______,C2极电极反应式为_______,若反应过程中阴极析出12.8g的Cu,则阳极产生的气体在标准状况下的体积为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com