
 ,B、C、D、E与A形成的化合物中稳定性最强的是H2O(填化学式).
,B、C、D、E与A形成的化合物中稳定性最强的是H2O(填化学式).
分析 短周期元素中主族序数、周期数、原子序数均相同的是H,则A为H元素;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料,非金属单质常用作电极的是碳,则B为C元素;D和A可形成化合物A2D和A2D2,且A2D是最常见的溶剂,则D为O元素;植物生长所需元素是N、P、K,又A、B、C、D、E均为短周期元素,且原子序数依次增大,则C为N元素;E原子次外层电子数等于其它层电子数之和,则E为第三周期元素S,据此进行解答.
解答 解:短周期元素中主族序数、周期数、原子序数均相同的是H,则A为H元素;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料,非金属单质常用作电极的是碳,则B为C元素;D和A可形成化合物A2D和A2D2,且A2D是最常见的溶剂,则D为O元素;植物生长所需元素是N、P、K,又A、B、C、D、E均为短周期元素,且原子序数依次增大,则C为N元素;E原子次外层电子数等于其它层电子数之和,则E为第三周期元素S,
(1)E为S元素,硫离子有三个电子层,电子数依次为2、8、8,离子结构示意图为 ,非金属性越强,对应氢化物的稳定性越强,C、N、O、S中非金属性O最强,稳定性最强的为H2O,
,非金属性越强,对应氢化物的稳定性越强,C、N、O、S中非金属性O最强,稳定性最强的为H2O,
故答案为: ;H2O;
;H2O;
(2)B2A5DA与D2分别为CH3CH2OH、O2,在铜作催化剂条件下加热,乙醇与氧气反应生成乙醛,反应的化学方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(3)根据转化关系可知,单质与氧气反应生成氧化物X,X与氧气反应生成氧化物Y,Y生成酸,酸可以生成X,这样的元素必须有变价,5种元素中满足条件的元素为:N、S,
故答案为:N、S;
(4)B2A5DA为CH3CH2OH,根据图可知,该原电池的燃料为乙醇和氧气,生成物乙酸和水,电解质为酸性溶液,原电池负极失去电子发生了氧化反应,所以负极反应为乙醇失去电子生成乙酸,电极反应为:CH3CH2OH+H2O-4e-=CH3COOH+4H+,正极在酸性条件下氧气得到电子发生了还原反应:O2+4H++4e-=2H2O,所以A处为H2O,
故答案为:CH3CH2OH+H2O-4e-=CH3COOH+4H+;H2O.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,明确原电池原理及其应用,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
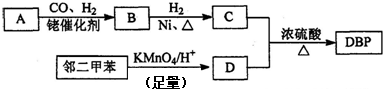
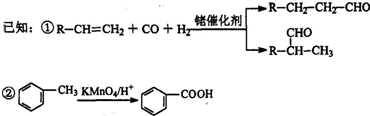


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH与CH2=CHCH2OH | |
| B. | CH3OH与HO-CH2-CH2-OH | |
| C. | HO-CH2-CH2-OH与HO-CH2-CH2-CH2-OH | |
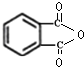
| D. |  与 与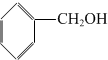 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用 品 |  |  |  |  |
| 主要成分 | CO2 | Fe2O3 | NaHCO3 | CH3COOH |
| 用途 | 做制冷剂 | 做红色涂料 | 除油污 | 做调味剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干 | |
| B. | 向1 mL浓度均为0.05 mol•L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol•L-1的AgNO3溶液,振荡,沉淀呈黄色.结论:Ksp(AgCl)<Ksp(AgI) | |
| C. | 0.1mol•L-1的NaOH溶液分别中和pH、体积均相等的醋酸和盐酸,所消耗NaOH溶液的体积:前者小于后者 | |
| D. | 水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ) 发生酯化反应的产物.
) 发生酯化反应的产物. 、
、 、
、 任意一种.
任意一种. ,R-ONa$→_{△}^{Cl-R′}$R-O-R′(R-、R′-表烃基)
,R-ONa$→_{△}^{Cl-R′}$R-O-R′(R-、R′-表烃基)
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应器,在 一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图.假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.03mol•L-1•min-1.
将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应器,在 一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图.假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.03mol•L-1•min-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. (任写一种).
(任写一种). 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com