
 ) 发生酯化反应的产物.
) 发生酯化反应的产物. 、
、 、
、 任意一种.
任意一种. ,R-ONa$→_{△}^{Cl-R′}$R-O-R′(R-、R′-表烃基)
,R-ONa$→_{△}^{Cl-R′}$R-O-R′(R-、R′-表烃基)
 .
. 分析 (1)化合物甲与苯氧乙酸( ) 发生酯化反应,则甲中含有羟基;
) 发生酯化反应,则甲中含有羟基;
(2)苯氧乙酸( ) 的同分异构体符合:含有酯基;能与FeCl3溶液发生显色反应,说明含有酚羟基;且苯环上有2种一硝基取代物,苯环上有2个取代基且处于对位位置,
) 的同分异构体符合:含有酯基;能与FeCl3溶液发生显色反应,说明含有酚羟基;且苯环上有2种一硝基取代物,苯环上有2个取代基且处于对位位置,
(3)甲蒸气对氢气的相对密度是29,则Mr(甲)=29×2=58,5.8g甲的物质的量=$\frac{5.8g}{58g/mol}$=0.1mol,质量守恒可知,参加反应的氧气的质量=0.3mol×44g/mol+0.3mol×18g/mol-5.8g=12.8g,氧气物质的量=$\frac{12.8g}{32g/mol}$=0.4mol,根据氧原子守恒,可知5.8g甲中n(O)=0.3mol×2+0.3mol-0.4mol×2=0.1mol,则甲分子中N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.3mol×2}{0.1mol}$=6、N(O)=$\frac{0.1mol}{0.1mol}$=1,故甲的分子式为C3H6O,甲分子中不含甲基,且为链状结构,故甲的结构简式是CH2=CH-CH2-OH;
(4)苯酚和氢氧化钠或钠反应生成苯酚钠,结合反应信息可知,逆推可知丙是ClCH2COOH,乙为CH3COOH,CH2=CH-CH2-OH和 发生酯化反应生成菠萝酯为
发生酯化反应生成菠萝酯为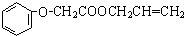 .
.
解答 解:(1)化合物甲与苯氧乙酸( ) 发生酯化反应,则甲中一定含有羟基,
) 发生酯化反应,则甲中一定含有羟基,
故答案为:羟基;
(2)苯氧乙酸( ) 的同分异构体符合:含有酯基;能与FeCl3溶液发生显色反应,说明含有酚羟基;且苯环上有2种一硝基取代物,苯环上有2个取代基且处于对位位置,所以其同分异构体是:
) 的同分异构体符合:含有酯基;能与FeCl3溶液发生显色反应,说明含有酚羟基;且苯环上有2种一硝基取代物,苯环上有2个取代基且处于对位位置,所以其同分异构体是: 、
、 、
、 ,
,
故答案为: 、
、 、
、 任意一种;
任意一种;
(3)甲蒸气对氢气的相对密度是29,则Mr(甲)=29×2=58,5.8g甲的物质的量=$\frac{5.8g}{58g/mol}$=0.1mol,质量守恒可知,参加反应的氧气的质量=0.3mol×44g/mol+0.3mol×18g/mol-5.8g=12.8g,氧气物质的量=$\frac{12.8g}{32g/mol}$=0.4mol,根据氧原子守恒,可知5.8g甲中n(O)=0.3mol×2+0.3mol-0.4mol×2=0.1mol,则甲分子中N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.3mol×2}{0.1mol}$=6、N(O)=$\frac{0.1mol}{0.1mol}$=1,故甲的分子式为C3H6O,甲分子中不含甲基,且为链状结构,故甲的结构简式是CH2=CH-CH2-OH,
故答案为:CH2=CH-CH2-OH;
(4)苯酚和氢氧化钠或钠反应生成苯酚钠,结合反应信息可知,逆推可知丙是ClCH2COOH,乙为CH3COOH,CH2=CH-CH2-OH和 发生酯化反应生成菠萝酯为
发生酯化反应生成菠萝酯为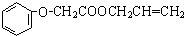 ,
,
①苯酚具有酸性但酸性弱于醋酸、碳酸,所以苯酚能和钠、氢氧化钠反应生成苯酚钠,不能和碳酸氢钠反应,故选:ac;
②通过以上分析知,其结构简式为:ClCH2COOH,
故答案为:ClCH2COOH;取代反应;
③在催化剂、加热条件下,CH2=CH-CH2-OH和 发生酯化反应生成菠萝酯,反应方程式为
发生酯化反应生成菠萝酯,反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,较好的考查学生的阅读能力、自学能力与知识迁移应用能力,题目难度中等,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )所示,回答下列问题.
)所示,回答下列问题.
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B、C、D、E与A形成的化合物中稳定性最强的是H2O(填化学式).
,B、C、D、E与A形成的化合物中稳定性最强的是H2O(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三者的氧化物均为酸性氧化物 | |
| B. | 三者的单质均存在同素异形现象 | |
| C. | CO2、SiO2、SO3都能与H2O反应,其反应类型相同 | |
| D. | 25℃时,物质的量浓度相同的三溶液的pH:Na2SiO3<Na2SO3<Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重结晶法提纯苯甲酸时,为了析出更多晶体,热滤液要用冰盐水充分冷却 | |
| B. | 自然界中无游离态的Na、K、Si、Fe,有游离态的S、O | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5在空气中不可能形成胶体 | |
| D. | 硅石、玛瑙、硅胶的主要成分是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下G中阴离子的电离平衡常数Ka=4×10-12
;取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下G中阴离子的电离平衡常数Ka=4×10-12查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式3HClO+2NH3=3HCl+N2+3H2O.
,该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式3HClO+2NH3=3HCl+N2+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L稀硫酸的实验步骤如下:
用98%的浓硫酸(密度为1.84g/mL)配制500mL 0.30mol/L稀硫酸的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com