
【题目】下列反应与![]() 相比,
相比,![]() 的作用相同的是( )
的作用相同的是( )
A.![]()
B.![]()
C.![]()
D.![]()
【答案】D
【解析】
反应Na2O2+ SO2=Na2SO4中SO2是还原剂,Na2O2是氧化剂。
A、Na2O2中O元素的化合价为-1价,反应过程中有部分O元素的化合价升高到0价,还有部分O元素化合价降低到-2价,故Na2O2既是氧化剂又是还原剂,选项A不相同;
B、Na2O2中O元素的化合价为-1价,反应过程中有部分O元素的化合价升高到0价,还有部分O元素化合价降低到-2价,故Na2O2 在反应中既是氧化剂又是还原剂,选项B不相同;
C、该反应是复分解反应,反应过程中各元素均没有发生化合价变化,不属于氧化还原反应,选项C不相同;
D、Na2O2 中O元素的化合价降低,Na2O2 是氧化剂,选项D相同。
答案选D。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为__(写离子符号);若所得溶液c(HCO3):c(CO32)=2:1,溶液pH=__。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=__。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是__(填“A”或“B”)。
(3)向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①下列叙述能说明此反应达到平衡状态的是___。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H-H键断裂
②产物甲醇可以用作燃料电池,碱性条件下的甲醇(CH3OH)燃料电池负极反应式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是______________(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为____________。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的化学方程式为_____________。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,,关闭活塞a。

① B中反应的离子方程式是________。
②通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.挥发性 B. 还原性 C. 氧化性 D. 酸性
③ C装置中的试剂X是________(写化学式)。D中反应的化学方程式是________。
④碳、硅的非金属性逐渐减弱的原因:碳和硅______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3mol甲烷燃烧时,生成液态水和二氧化碳,同时放出2670.9kJ的热量,写出该反应的热化学方程式___。
(2)当1g氨气完全分解为N2和H2时,吸收2.7kJ的热量,写出其热化学方程式:___。
(3)HCl和NaOH反应的中和热ΔH= -57.3kJ/mol,则H2SO4和NaOH反应的中和热的热化学方程式:___。
(4)2g H2完全燃烧生成液态水,放出285.8kJ热量,写出该反应的热化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温下,10 mLpH=1的醋酸溶液中含有的氢离子数为0.001NA
B. 合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目等于NA
D. 常温常压下,18.4gNO2和N2O4的混合气体中含有的氮原子总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某![]() 的溶液X,其中可能含有
的溶液X,其中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种,取200 mL该溶液进行实验,其现象及转化如图.
中的一种或几种,取200 mL该溶液进行实验,其现象及转化如图.
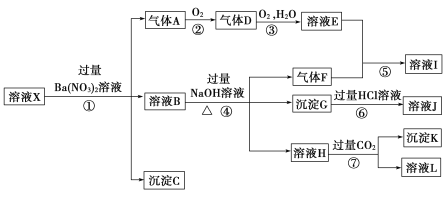
已知:反应过程中有一种气体是红棕色.
请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有________.
(2)溶液X中,关于![]() 的判断一定正确的是________(填字母).
的判断一定正确的是________(填字母).
a.一定有 b.一定没有 c.可能有
(3)①中产生气体A的离子方程式为_____________________________________________________.
(4)⑦中生成沉淀K的离子方程式为_____________________________________________________.
(5)溶液X中不能确定的离子是_____________________用实验证明该离子一定不存在的化学方法为______________________________________________________________________________________.
(6)若实验测定A.F.K均为![]() l,试确定沉淀C及其物质的量范围:_________.
l,试确定沉淀C及其物质的量范围:_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为HOOC![]() CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成生成1mol H2
D. HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com