
����Ŀ��ij![]() ����ҺX�����п��ܺ���
����ҺX�����п��ܺ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �е�һ�ֻ��֣�ȡ200 mL����Һ����ʵ�飬������ת����ͼ��
�е�һ�ֻ��֣�ȡ200 mL����Һ����ʵ�飬������ת����ͼ��
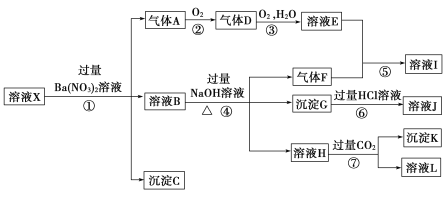
��֪����Ӧ��������һ�������Ǻ���ɫ��
��ش��������⣺
��1������ǿ������������ж���ҺX��һ�������ڵ�������________��
��2����ҺX�У�����![]() ���ж�һ����ȷ����________������ĸ����
���ж�һ����ȷ����________������ĸ����
a��һ���� b��һ��û�� c��������
��3�����в�������A�����ӷ���ʽΪ_____________________________________________________��
��4���������ɳ���K�����ӷ���ʽΪ_____________________________________________________��
��5����ҺX�в���ȷ����������_____________________��ʵ��֤��������һ�������ڵĻ�ѧ����Ϊ______________________________________________________________________________________��
��6����ʵ��ⶨA��F��K��Ϊ![]() l����ȷ������C�������ʵ�����Χ��_________��
l����ȷ������C�������ʵ�����Χ��_________��
���𰸡�![]() ��
��![]() b
b ![]()
![]()
![]() ��ȡ������ҺX���Թ��У����뼸��KSCN��Һ����Һ�����ɫ��˵����
��ȡ������ҺX���Թ��У����뼸��KSCN��Һ����Һ�����ɫ��˵����![]() �������𰸺���Ҳ�ɣ� ����Ϊ
�������𰸺���Ҳ�ɣ� ����Ϊ![]()
![]()
��������
�ɷ�Ӧ�ټ����Ba(NO3)2��Һ��pH= 1�������Һ�п��ܺ��е����ӵ���Ϣ���ж�����AΪNO������DΪNO2����ҺEΪHNO3�������Һ�к��л�ԭ�Ե����ӣ�������Fe2+���ɷ�Ӧ�ܼ������NaOH��Һ����Һ�п��ܴ��ڵ������ж�����FΪNH3����ҺIΪNH4NO3����Һ�к���NH4+; pH= 1����Һ�в����ܺ���CO32-��SiO32-, �ʳ���CΪBaSO4;����ͼʾ��ϵ�����ܴ��ڵ����ӿ�֪����GΪFe(OH)3����ҺJΪFeCl3;����KΪAl(OH)3��
��1����ǿ�������������ж���ҺX��һ����������������ӣ����Բ����ڵ�������CO32-��SiO32-��
��2��ǿ������Һ����������Ӿ���ǿ�����ԣ����������������ӣ������������ӣ��������ᱵ��Һʱ���ܲ������壬������ҺX��һ��û��NO3-��
��ѡb��
��3���������Ӻ����ᷴӦ���������ӡ�һ��������ˮ�����ӷ�Ӧ����ʽΪ��3Fe2++NO3-+4H+=3Fe3++NO��+2H2O��
��4���������ɳ���KΪAl(OH)3����Ӧ�����ӷ���ʽΪAlO2-+CO2+2H2O= Al(OH)3��+HCO3-��
(5)����Fe(OH)3��Fe3+����������Fe2+������������Ҳ������ԭ����Һ�оʹ���Fe3+���ʲ���ȷ����ҺX���Ƿ����Fe3+������KSCN��Һ������ҺX���Ƿ����Fe3+��
(6) NO��NH3��Al(OH)3 ��Ϊ0.01 mol����˵����ҺX����0.03molFe2+�� 0.01 mol NH4+��0.01 mol Al3+�� ����ҺX�в�����Fe3+,�������ƶϿ�֪��Һ��һ������Al3+��NH4+��Fe2+�� SO42-������Һ�еĵ���غ��֪3n(Al3+) + n(NH4+)+ 2n(Fe2+)+ n(H+)= 2n(SO42-)����n(SO42-)= ![]() (0.03mol+0.01mol + 0.06 mol+ 0.02 mol)= 0.06 mol,����Һ�к���Fe3+����n(SO42- )>0.06 mol��
(0.03mol+0.01mol + 0.06 mol+ 0.02 mol)= 0.06 mol,����Һ�к���Fe3+����n(SO42- )>0.06 mol��


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ʒ�������п�����������������Ʒ�ı�������һ�����ܵ�Fe3O4��ijѧϰС��Ϊ���о�������Ƭ���ֱ����������ʵ�������
����һ����������Ƭ�ӹ��ɾ��ȷ�ĩ��
��ȡm g�÷�ĩ������28.00 mL 1 mol��L��1����������ǡ����ȫ��Ӧ�����ɱ�״���µ�����134.4 mL������Һ�е���KSCN��Һ��������������
����������
(1)����Ӧ�����Һϡ����100 mL������Һ��c(Fe2��)��________mol��L��1��
(2)��Ʒ��n(Fe)��n(Fe3O4)��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԻ�ѧƽ���ƶ��ķ����У�����ȷ����
���Ѵ�ƽ��ķ�ӦC(s)��H2O(g)![]() CO(g)��H2(g)�������ӷ�Ӧ�����ʵ���ʱ��ƽ��һ��������Ӧ�����ƶ������Ѵ�ƽ��ķ�ӦN2(g)��3H2(g)
CO(g)��H2(g)�������ӷ�Ӧ�����ʵ���ʱ��ƽ��һ��������Ӧ�����ƶ������Ѵ�ƽ��ķ�ӦN2(g)��3H2(g)![]() 2NH3(g)��������N2��Ũ��ʱ��ƽ��������Ӧ�����ƶ���N2��ת����һ������ ��������μӵķ�Ӧ�ﵽƽ��ʱ������С��Ӧ���ݻ�ʱ��ƽ��һ���������������ķ����ƶ�����������μӵķ�Ӧ��ƽ��ʱ���ں�ѹ��Ӧ���г���ϡ�����壬ƽ��һ�����ƶ�
2NH3(g)��������N2��Ũ��ʱ��ƽ��������Ӧ�����ƶ���N2��ת����һ������ ��������μӵķ�Ӧ�ﵽƽ��ʱ������С��Ӧ���ݻ�ʱ��ƽ��һ���������������ķ����ƶ�����������μӵķ�Ӧ��ƽ��ʱ���ں�ѹ��Ӧ���г���ϡ�����壬ƽ��һ�����ƶ�
A.�٢�B.�٢ڢ�C.�ڢۢ�D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ҺX�п��ܺ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �е����������ӣ�ij��ȤС�����������ʵ�飮��������1�ڿ������ܱ�Ϊ����ɫ��
�е����������ӣ�ij��ȤС�����������ʵ�飮��������1�ڿ������ܱ�Ϊ����ɫ��

������Ӧ��û�����ɵ������ǣ�������
A.NOB.![]() C.
C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ���ȡCu2O�ĵ���ʾ��ͼ����ͼ��ʾ������ܷ�ӦΪ��2Cu��H2O![]() Cu2O��H2��������˵����ȷ����
Cu2O��H2��������˵����ȷ����

A. ͭ�缫������ԭ��Ӧ B. ʯī�缫�ϲ�������
C. ͭ�缫��ֱ����Դ�ĸ��� D. ����0.1 mol����ת��ʱ����0.1 mol Cu2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���A�ĺ�����ͺ˴Ź�����������ͼ��ʾ������˵���д�����У� ��
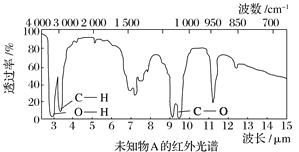
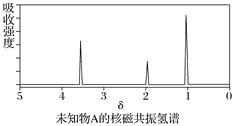
A. �ɺ������֪�����л��������ٺ������ֲ�ͬ�Ļ�ѧ��
B. �ɺ˴Ź�������֪�����л�������������ֲ�ͬ��ѧ��������ԭ��
C. ��A�Ļ�ѧʽΪC2H6O������ṹ��ʽΪCH3��O��CH3
D. ������˴Ź�����������֪������е���ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�ʱ����2.0L�����ܱ������г���2molSO2��1mol O2��������Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
2SO3(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
����˵����ȷ���ǣ� ��
A.��Ӧ��ǰ2s��ƽ������v(O2)��0.2mol��L��1��s��1
B.���������������䣬���ѹ����1.0L��ƽ�ⳣ��������
C.��ͬ�¶��£���ʼʱ�������г���4molSO3���ﵽƽ��ʱ��SO3��ת���ʴ���10%
D.�����¶Ȳ�������������ٳ���2molSO2��1molO2����Ӧ�ﵽ��ƽ��ʱ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӵ����ڶ��㻨�Ļ����У��Զ����Ϊԭ����ȡ�л��� F ��·�����£�

��֪��![]()
��1������ӵķ���ʽΪ_______��
�� 2�� A �еĺ�����������_______�� �����ƣ��� �� �ķ�Ӧ����Ϊ_______��
��3��д���������������� C ������ͬ���칹��Ľṹ��ʽ_______��
�ٺ������һ���ֻ������ȡ������
������������
�ۺ˴Ź��������� 3 ��壬�ҷ����֮��Ϊ 3��1��1��
��4��1 mol D ��������_______molH2 �����ӳɷ�Ӧ��
��5����Ӧ���У��Լ� X �Ľṹ��ʽΪ_______��
��6�������ૼ�ȩ�� ![]() ���ͻ�����Ϊԭ����
���ͻ�����Ϊԭ���� ![]() �ĺϳ�·��_______�����Լ���ѡ����
�ĺϳ�·��_______�����Լ���ѡ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com