
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为__(写离子符号);若所得溶液c(HCO3):c(CO32)=2:1,溶液pH=__。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=__。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是__(填“A”或“B”)。
(3)向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①下列叙述能说明此反应达到平衡状态的是___。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H-H键断裂
②产物甲醇可以用作燃料电池,碱性条件下的甲醇(CH3OH)燃料电池负极反应式:__。
【答案】CO32- 10 +120kJ·mol-1 B de CH3OH+6e-+8OH-=CO32-+6H2O
【解析】
(1)根据K2=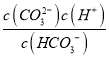 =5×10-11,结合溶液的pH=13分析判断;再结合溶液c(HCO3-):c(CO32-)=2:1,计算溶液pH;
=5×10-11,结合溶液的pH=13分析判断;再结合溶液c(HCO3-):c(CO32-)=2:1,计算溶液pH;
(2)根据△H=反应物总键能-生成物总键能计算;该反应的正反应是气体物质的量增大的反应,结合增大压强平衡逆向移动分析判断;
(3)①可能反应到达平衡时,正逆反应速率相等,各组分的浓度、含量不变,由此衍生的其它-一些物理量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化,说明到达平衡;
②碱性条件下的甲醇(CH3OH)在负极上失电子产生碳酸根离子。
(1)K2=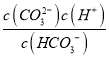 =5×10-11,则c(H+)=
=5×10-11,则c(H+)=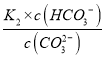 ,当c(HCO3-)=c(CO32-),c(H+)=5×10-11,pH在10.3,如果溶液的pH=13,则c(HCO3-)<<c(CO32-),所以该溶液中所得阴离子为c(CO32-);
,当c(HCO3-)=c(CO32-),c(H+)=5×10-11,pH在10.3,如果溶液的pH=13,则c(HCO3-)<<c(CO32-),所以该溶液中所得阴离子为c(CO32-);
K2=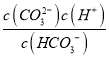 =5×10-11,且所得溶液c(HCO3-):c(CO32-)=2:1,c(H+)=
=5×10-11,且所得溶液c(HCO3-):c(CO32-)=2:1,c(H+)=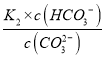 =5×10-11×2=1×10-10,pH=10;
=5×10-11×2=1×10-10,pH=10;
(2)该反应的△H=反应物总键能-生成物总键能=[4×413+2×745-2×1075-2×436]kJ/mol =+120kJ/mol;
该反应的正反应是气体物质的量增大的反应,增大压强平衡逆向移动,A在反应过程中压强在不断增大、B在反应过程中压强不变,所以A相当于B来说是增大压强,平衡逆向移动,所以A中反应物转化率小于B,则两容器中反应达平衡后吸收的热量较多的是B,故答案为B;
(3)①CO2(g) +3H2(g)=CH30H(l) +H20(l),
a、向2L密闭容器中加入2mol CO2.6molH2, 按照1 : 3反应,所以混合气体的平均相对分子质量始终保持不变,不能说明反应达到平衡状态,选项a错误;
b、向2L密闭容器中加入2mol CO2、6molH2 ,按照1 : 3反应,所以过程中CO2和H2的体积分数始终保持不变,选项b错误;
c、向2L密闭容器中加入2molCO2、6molH2, 按照1 : 3反应, CO2和H2的转化率始终相等, 不能确定反应是否达到平衡状态,选项c错误;
d、反应物是气体,生成物是液体,混合气体的密度保持不变,说明反应达到平衡状态,选项d正确;
e、1mol CO2生成的同时有3 mul H―H键断裂,符合v正=v逆,达到平衡状态;选项e正确;
答案选de;
②碱性条件下的甲醇(CH3OH)燃料电池负极上甲醇在碱性条件下失电子产生碳酸根离子,电极反应式为CH3OH+6e-+8OH-=CO32-+6H2O。


科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)既能消毒杀菌,又能净水,是一种理想的水处理剂。工业 上制备高铁酸钾的一种工艺流程如下:
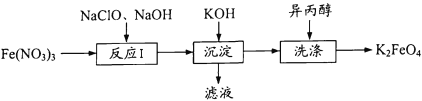
(1)K2FeO4中铁元素的化合价为 ____。
(2) “反应I”中参加反应的Fe3+与ClO-的物质的量之比为2 : 3,则滤液中含氯物质的化学式为____。写出“反应I”的离子方程式:_____。
(3)K2FeO4在水中发生反应:4K2FeO4+ 10H2O = 4Fe(OH)3 (胶体)+8KOH+3O2 ↑。高铁酸钾能消毒杀菌是因为____;它能净水是因为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】30 mL1 mol·L-1NaCl溶液和40 mL0.5 mol·L-1CaCl2溶液混合后,混合液中Cl-浓度为(假设溶液体积混合前后不变)( )
A.0.5 mol·L-1B.0.6 mol·L-1C.1.0 mol·L-1D.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以![]() 和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物,该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物,该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A.![]() 的还原性强于金刚石B.另一种化合物是
的还原性强于金刚石B.另一种化合物是![]()
C.纳米级金刚石粉末可以透过半透膜D.这个反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含下表离子中的几种,且各离子的物质的量浓度相等(不考虑水的电离与离子水解)。
阳离子 | K+、NH4+、Fe2+、Mg2+、Cu2+ |
阴离子 | OH-、Cl-、CO32-、SO42- |
某同学进行了如下实验(必要时可加热):

下列说法正确的是
A. 由沉淀A推断原溶液中一定含有SO42-
B. 原溶液中只含有NH4+、Fe2+、Cl-、SO42-
C. 滤液A中可能含有K+
D. 沉淀B中一定含有Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00mL浓度约为0.1mol·L-1 HA溶液中逐滴加入0.1000mol·L-1的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
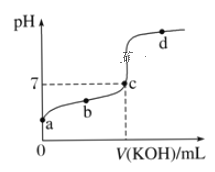
(1)a、b、c、d四点中水的电离程度最大的是_______点,滴定过程中宜选用__________作指示剂,滴定终点在__________(填“c点以上”或“c点以下”)。
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_____(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____mol/L。(保留4位有效数字)
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
(4)a点溶液中pH约为________,此时溶液中H2O电离出的c(H+)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
Ⅰ.现有下列10种物质:①熔融的氢氧化钠②蔗糖③盐酸④金属钠⑤硫酸⑥二氧化硫⑦硫粉⑧石膏![]() ⑨酒精溶液⑩液氨
⑨酒精溶液⑩液氨
(1)属于电解质的是_______________(填序号,下同)。
(2)属于非电解质的是_____________。
(3)上述状态下能导电的是__________。
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示。请回答下列问题:
84消毒液
[有效成分]![]()
[规格]![]()
[质量分数]25%
[密度]![]()
(1)![]() 的物质的量浓度约为________
的物质的量浓度约为________![]() (保留两位有效数字)。
(保留两位有效数字)。
(2)某同学参阅该“84消毒液”的配方,欲用![]() 固体配制
固体配制![]() 含
含![]() 质量分数为25%的消毒液。下列说法正确的是___________(填字母)。
质量分数为25%的消毒液。下列说法正确的是___________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
![]()
![]()
![]()

![]()
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量![]() 固体的质量为
固体的质量为![]()
E.配制过程中,定容时俯视刻度线会使得溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.5 g Zn放入5 L 0.1mol/L 的盐酸中,待Zn完全反应后,试计算:
(1)6.5 g Zn的物质的量________。
(2)生成氢气的体积________。
(3)反应后剩余HCl的物质的量________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所给信息和标志,判断下列说法错误的是( )
A | B | C | D |
碳酸氢钠药片
| 铜片制成的“纳米铜”在空气中易燃烧 |
| “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒 |
过量服用阿司匹林引起酸中毒后,可服用碳酸氢钠药片解毒 | 说明“钠米铜”的金属性比铜片强 | 看到有该标识的丢弃物,应远离并报警 | 在酿酒过程中,发生的反应有水解反应、氧化还原反应等 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com