
【题目】秸秆(含多糖物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:

回答下列问题:
(1)下列关于糖类的说法正确的是______________。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为______。
(3)D中官能团名称为______,D生成E的反应类型为______。
(4)F 的化学名称是______,由F生成G的化学方程式为______。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成44 gCO2,W共有______种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为_________。
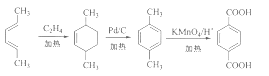
(6)参照上述合成路线,以(反,反)-2,4-己二烯和C2H4为原料(无机试剂任选),设计制备对二苯二甲酸的合成路线_______________________。
【答案】 cd 取代反应(或酯化反应) 酯基、碳碳双键 消去反应 己二酸 nHOOC(CH2)4COOH+nHOCH2CH2CH2CH2OH![]()
![]() +(2n-1)H2O 12
+(2n-1)H2O 12 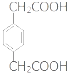
【解析】试题分析:(1)a.糖类不一定有甜味,如纤维素等,组成通式不一定都是CnH2mOm形式,如脱氧核糖(C6H10O4),故a错误;b.葡萄糖与果糖互为同分异构体,但麦芽糖水解生成葡萄糖,故b错误;c.淀粉水解生成葡萄糖,能发生银镜反应说明含有葡萄糖,说明淀粉水解了,不能说明淀粉完全水解,故c正确;d.淀粉和纤维素都属于多糖类,是天然高分子化合物,故d正确,故选:cd;
(2)B与甲醇发生酯化反应生成C,属于取代反应,故答案为:酯化反应或取代反应;
(3)由D的结构简式可知,含有的官能团有酯基、碳碳双键,D脱去2分子氢气形成苯环得到E,属于氧化反应,故答案为:酯基、碳碳双键;氧化反应;
(4)F的名称为己二酸,己二酸与1,4-丁二醇发生缩聚反应生成![]() ,反应方程式为:n HOOC(CH2)4COOH+n HOCH2CH2CH2CH2OH
,反应方程式为:n HOOC(CH2)4COOH+n HOCH2CH2CH2CH2OH![]()
![]() +(2n-1)H2O,故答案为:己二酸;n HOOC(CH2)4COOH+n HOCH2CH2CH2CH2OH
+(2n-1)H2O,故答案为:己二酸;n HOOC(CH2)4COOH+n HOCH2CH2CH2CH2OH![]()
![]() +(2n-1)H2O;
+(2n-1)H2O;
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5mol W与足量碳酸氢钠溶液反应生成44gCO2,生成二氧化碳为1mol,说明W含有2个羧基,2个取代基为-COOH、-CH2CH2COOH,或者为-COOH、-CH(CH3)COOH,或者为-CH2COOH、-CH2COOH,或者-CH3、-CH(COOH)2,各有邻、间、对三种,共有12种,其中核磁共振氢谱为三组峰的结构简式为:![]() ,故答案为:12;
,故答案为:12;![]() ;
;
(6)(反,反)-2,4-己二烯与乙烯发生加成反应生成![]() ,在Pd/C作用下生成
,在Pd/C作用下生成![]() ,然后用酸性高锰酸钾溶液氧化生成
,然后用酸性高锰酸钾溶液氧化生成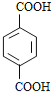 ,合成路线流程图为:
,合成路线流程图为: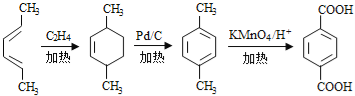 ,故答案为:
,故答案为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)标准状况下,①6.72 L NH3 ②1.204×1023个 H2S ③5.6 g CH4 ④0.5 mol HCl ,下列关系按由大到小排序
A.体积大小:___________________ B.质量大小:________________
C.密度大小:___________________D.原子数目:_________________
(2)标准状况下,33.6 L的HCl所具有的物质的量为_____________,将其溶解于水配成3 L的溶液,所得盐酸的物质的量浓度为__________。
(3)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________
(4)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为_________
(5)0.5 L 1 mol/L CaCl2溶液中Ca2+的物质的量为_________,Cl的物质的量浓度为________
(6)0.3 mol NH3分子中所含原子数与___________个H2O分子中所含原子数相等
相同质量的SO2、SO3的物质的量之比为____________;氧原子的个数之比为___________
在0℃和101kPa的条件下,将2.00g氦气、1.40g氮气和1.60g氧气混合,该混合气体的体积是________L
若1gN2含a个原子,则阿伏加德罗常数可表示为_____________
由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO![]() )= 0.6 mol/L,则c(K+)为________
)= 0.6 mol/L,则c(K+)为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香蕉果实成熟过程中,果实中的贮藏物不断代谢转化,香蕉逐渐变甜。图A中 Ⅰ、Ⅱ 两条曲线分别表示香蕉果实成熟过程中两种物质含量的变化趋势。取成熟到第X天和第Y天的等量香蕉果肉,分别加等量的蒸馏水制成提取液。然后在a、b试管中各加5 mL第X天的提取液,在c、d试管中各加5 mL第Y天的提取液,如图B所示。
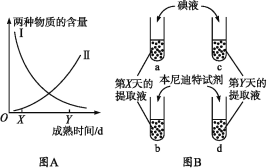
请回答下列问题。
(1)在a、c试管中各加入等量碘液后,a管呈蓝色,与a管相比c管的颜色更____,两管中被检测的物质是____,图A中表示这种物质含量变化趋势的曲线是____。
(2)在b、d试管中各加入等量的本尼迪特试剂,热水浴中加热2~3 min后,b管呈红黄色,与b管相比d管的颜色更____,两管中被检测的物质是____,图A中表示这种物质含量变化趋势的曲线是____。
(3)已知乙烯利能增加细胞内乙烯(能促进果实成熟)的含量。如果在第X天喷施乙烯利,从第X天开始曲线Ⅰ将呈现出____(“加快”或“减慢”)下降的趋势,曲线Ⅱ将呈现出____(“加快”或“减慢”)上升的趋势。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法的原理是将二氧化碳通入到溶有氨气的饱和食盐水中发生反应:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的NaHCO3,实验包括:制取氨气-制取NaHCO3-分离NaHCO3-干燥NaHCO3四个步骤。下列实验选用的主要仪器不正确的是

A. 制取氨气,选用②③ B. 制取NaHCO3,选用⑨
C. 分离NaHCO3,选用④⑤⑦ D. 干燥NaHCO3,选用①⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品醇可作为消毒剂、抗氧化剂、溶剂和医药中间体。合成α-萜品醇(G)的路线之一如下:

其中E的化学式为C8H12O2,请回答下列问题:
(1)A中含有的官能团名称是________;C的结构简式为________。
(2)由化合物C制取化合物D的反应类型为________;有人提出可以由化合物B直接在浓硫酸中加热也可以获得化合物E,但很快遭到反对,你认为可能原因是_________________________________。
(3)试写出由化合物E制取化合物F的化学方程式:_______________________________________。
(4)化合物A满足下列条件的同分异构体有________种。
a.为链状有机物且无支链
b.能发生银镜反应
c.能和碳酸氢钠反应生成气体
(5)下列说法正确的是________(填写序号)。
a.A的核磁共振氢谱有4种峰
b.B可与FeCl3溶液发生显色反应
c.G中所有原子可能在同一平面上
d.G可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
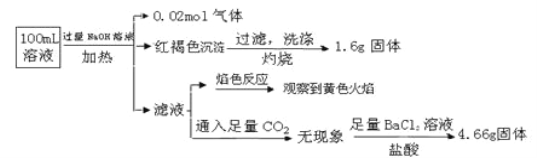
下列说法正确的是( )
A. 原溶液中c(Fe3+)=0.2 molL-1
B. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
C. SO42-、NH4+、Na+、CO32-一定存在,Cl-可能存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中加入0.100molNO和2.030mol固体活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表,下列说法正确的是
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表,下列说法正确的是
温度 | C(s)/mol | NO/mol | N2/mol | CO2/mol |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
A. 该反应的正反应为吸热反应
B. 反应体系在335℃时的平衡常数为0.25
C. 335℃与200℃时相比,活化分子个数、活化分子百分数、活化能及焓变均大
D. 200℃时,平衡后向恒容容器中再充入0.10molNO,再次平衡时,NO的百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“毒奶粉”事件再次提醒我们要注意食品安全,下列有关食品加工方法安全的是( )
A.用工业盐(含NaNO2)来做食品添加剂
B.用塑料颗粒来制作珍珠奶茶中的“珍珠”
C.用工业酒精勾兑水来生产低成本白酒
D.用小苏打来作焙制糕点的发酵粉成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量
② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com