

| 6.4g |
| 32g/mol |


科目:高中化学 来源: 题型:
A、溶液中c(H+)=
| ||
B、物质的量浓度c(HA)=
| ||
C、t℃时,HA的溶解度S=
| ||
D、HA的质量分数w(HA)=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量SO2气体通入NaClO溶液中SO2+2ClO-+H2O═SO32-+2HClO |
| B、苯酚钠溶液中通入少量的二氧化碳气体C6H5O-+CO2+H2O═C6H5OH+HCO3- |
| C、足量的溴化亚铁溶液和少量的氯气反应2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向氯化铝溶液中加入过量的氨水Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
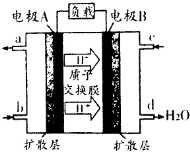 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.| [NH3?H2O] | ||
[N
|
| 5.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH皆等于3 的两种溶液都稀释100倍后,pH都为5 |
| B、10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
| C、在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
| D、室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系可能是:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L Na2CO3溶液中的Na+数目为2NA |
| B、电解Na2CO3饱和溶液,若生成2NA个H2,一定生成NA个O2 |
| C、常温常压下,46g NO2的原子数为3NA |
| D、1mol Na2O2与H2O完全反应时转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠的焰色反应(铂丝、氯化钠溶液、稀盐酸) |
| B、蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液) |
| C、硫酸铜晶体里结晶水含量的测定(坩埚、温度计、硫酸铜晶体) |
| D、肥皂的制取(蒸发皿、玻璃棒、甘油) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com