
【题目】羰基铁[Fe(CO)5]广泛用于催化剂,汽油抗爆剂,电子工业高频线圈制造。请回答下列问题:
(1)羰基铁[Fe(CO)5]中,碳、氧电负性大小比较____(用元素符号表示)。写出基态O的轨道表示式____;
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为____杂化。
(3)1molFe(CO)5分子中含σ键数目为____;CO配体中的配位原子是____。
(4)科学家通过X射线探明,FeO、MgO、CaO的晶体结构与NaCl晶体结构相似,比较晶体熔点的高低MgO____CaO(填“高于”或“低于”)
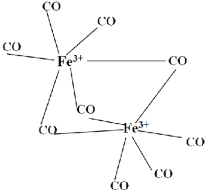
(5)羰基铁[Fe(CO)5]中铁为0价。如图中的羰基铁为+3价,此羰基铁的晶体类型为____;此羰基铁中每个铁的配位数是____。
【答案】O>C 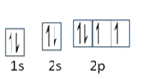 sp 10NA C 高于 分子晶体 3
sp 10NA C 高于 分子晶体 3
【解析】
(1)同周期元素电负性从左到右依次增大,故电负性O>C;基态O的电子排布式为1s22s22p4,它的轨道表示式为 ;
;
(2)根据题意可以推测出CO分子中有一条配位键,孤电子对数为1,σ键数为1,价层电子对数为2(结构式为![]() ,与三键相似),故C原子为sp杂化;
,与三键相似),故C原子为sp杂化;
(3)Fe(CO)5分子中CO与Fe之间的配位键是σ键,每个CO中有1个配位键也是σ键,故每个Fe(CO)5分子共有10个σ键,1molFe(CO)5分子中含σ键数目为10NA;由题意可知,CO分子中C原子上有一对孤对电子,所以CO中的C与Fe形成配位键;
(4)MgO和CaO都是离子晶体,熔沸点由晶格能决定,离子所带电荷数越多,离子半径越小,晶格能越大,熔沸点越高。Mg2+半径小于Ca2+半径,故MgO熔点高于CaO;
(5)由图可知,该羰基铁(III)可以看做是2个五羰基铁[Fe(CO)5]的二聚物,五羰基铁[Fe(CO)5]是分子晶体,故该化合物为分子晶体;该羰基铁(III)的形成过程是2个五羰基铁聚合,生成该羰基铁(III)和一个CO,中间的3个CO中的C与Fe成键,使Fe呈+3价,不属于配位键,故每个Fe的配位键只有3个;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为________L,NO2的体积为________L。
(2)待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中Cu2+全部转化成沉淀,则原硝酸溶液的浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l)C2H5OH(l) ΔH=-44.2kJ·mol-1;
2CO2(g)+2H2O(l)C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1。
已知2CO2(g)+3H2O(l)C2H5OH(l)+3O2(g),其正反应的活化能为Ea kJ·mol1,则逆反应的活化能为__kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,其水解反应的离子方程式为__,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为__。
(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1mol CO2和3mol H2,在三种不同催化剂作用下发生反应,相同时间内CO2的转化率随温度变化曲线如图所示:
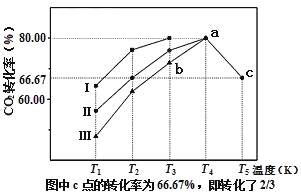
①催化剂效果最佳的反应是__(填“曲线I”,“曲线II”,“曲线III”)。
②b点,υ(正)__υ(逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是__。
④c点时该反应的平衡常数K=__。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
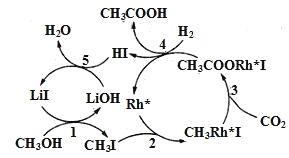
①根据图示,写出总反应的化学方程式:__。
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是
A.向NaClO溶液中通入少量CO2制取次氯酸:ClO-+H2O+CO2=HClO+HCO3-
B.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-=Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是

A. 单质①是最活泼的非金属单质
B. 单质②能使品红溶液褪色
C. 保存少量的单质③时加少量水进行水封
D. 单质④的氢化物在卤素氢化物中沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
(1)b、c、d中第一电离能最大的是______![]() 填元素符号
填元素符号![]() ,
,
(2)a和其他元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是______![]() 填化学式,写出两种
填化学式,写出两种![]() .
.
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是______;酸根呈三角锥结构的酸是______![]() 填化学式
填化学式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为有关分子在催化剂作用下发生转化的示意图,下列叙述正确的是( )。
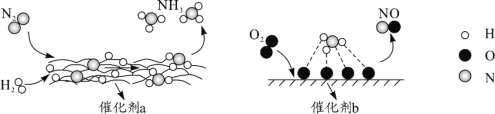
A.N2→NH3,NH3→NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A.制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO ![]() Mg
Mg
B.冶炼铝:铝土矿![]() NaAlO2
NaAlO2 ![]() 无水 AlCl3
无水 AlCl3![]() Al
Al
C.制硝酸: N2、H2![]() NH3
NH3![]() NO
NO![]() 50%HNO3
50%HNO3![]() 浓 HNO3
浓 HNO3
D.海带![]() 海带灰
海带灰![]() I2(aq)
I2(aq) ![]() I2
I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________。(填序号)
A.制汽轮机 | B.制有色玻璃 |
C.制永久性模具 | D.制造柴油机 |
(2)写出N的原子结构示意图__________,根据元素周期律知识,请写出氮化硅的化学式_________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式___________________________________。
(4)现用四氯化硅与氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com