
【题目】下列反应中属于氧化还原反应,但不属于四种基本反应类型的是 ( )
A. CuO + H2 ![]() Cu + H2O B. Fe2O3 + 3CO
Cu + H2O B. Fe2O3 + 3CO ![]() 2Fe + 2CO2
2Fe + 2CO2
C. 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑ D. NaOH + HCl = NaCl + H2O
K2MnO4 + MnO2 + O2↑ D. NaOH + HCl = NaCl + H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的是( )
A. 1s22s22p63s23p5 B. 1s22s22p3
C. 1s22s22p2 D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是几种原子的基态电子排布,电负性最大的原子是
A. 1s22s22p4 B. 1s22s22p63s23p3 C. 1s22s22p63s23p2 D. 1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需要配制450 mL 0.5 mol·L-1的NaOH溶液。请回答下列问题:
(1)在实验过程中用到的玻璃仪器有:玻璃棒、量筒、烧杯、______________、胶头滴管、试剂瓶。
(2)用托盘天平称量时,应将NaOH放在________称量,称取的固体质量为_______。
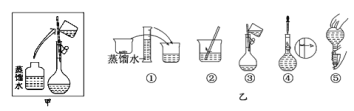
(3)配制时操作步骤如乙图所示,则甲图操作应在乙图中的___(填选项字母)之间。
A.①与② B.②与③ C.③与④ D.④与⑤
(4)配制过程中洗涤烧杯、玻璃棒2~3次的目的是______________________。
(5)定容滴加蒸馏水时,若不慎超过了刻度线,则处理的方法是______________。
(6)该同学实际配制NaOH溶液的浓度为0.6 mol·L-1,原因可能是____(填序号)。
a.砝码上有杂质
b.洗净的容量瓶中残留有少量水
c.称量NaOH固体时,采用了“左码右物”
d.定容时俯视刻度线
e.定容摇匀后发现液面低于刻度线又加入少许水调至刻度线
f.溶解固体的烧杯移液后未洗涤
g.定容前溶液未进行冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. π键是原子轨道以“肩并肩”方式相互重叠而形成的
B. 2个原子形成的多重共价键中,只能有一个是σ键,而π键可以是一个或多个
C. s电子与s电子间形成的键是σ键,p电子与p电子间形成的键是π键
D. 共价键一定有原子轨道的重叠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年,中科院大连化学物理研究所碳资源小分子与氢能利用创新特区研究组(DNL19T3)孙剑、葛庆杰研究员团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1) 工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应的化学方程式为_____________。在用氨水吸收前,烟气需冷却至15.5~26.5℃的可能原因是_________________。
(2) 该研究成果用CO2制取高辛烷值汽油的路线是先将CO2按逆水煤气反应生成CO,然后由CO与H2反应生成烃,产物中汽油组分占所有烃类产物的百分比近80%。
① 已知:H2 (g)+![]() O2 (g) === H2O(l) ΔH1= —285.8 kJ·mol-1
O2 (g) === H2O(l) ΔH1= —285.8 kJ·mol-1
C8H18(l)+![]() O2(g) === 8CO2(g)+9H2O(l) ΔH3= —5518 kJ·mol-1
O2(g) === 8CO2(g)+9H2O(l) ΔH3= —5518 kJ·mol-1
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方
程式__________________________。
② 在一实验容器中充入一定量的CO2和H2,若加入催化剂恰好完全反应,且产物只生成C5以上的烃类物质和水,则CO2与H2的物质的量之比不低于________。
(3) 二甲醚(CH3OCH3)的十六烷值高,燃烧尾气中污染物少,可代替柴油。CO、CO2混合加氢的方法是在一个反应器中将合成气直接转化为二甲醚,包括以下4个反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ①
CH3OH(g)+H2O(g) ①
CO2(g)+H2(g)![]() CO(g)+H2O(g) ②
CO(g)+H2O(g) ②
CO(g)+2H2(g)![]() CH3OH(g) ③
CH3OH(g) ③
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ④
CH3OCH3(g)+H2O(g) ④
① 已知反应④在某温度下的平衡常数为K=400。此温度下,在一恒容密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
此时正、逆反应速率的大小:v(正) ______ v(逆) (填“>”、“<”或“=”)。
若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=_____。
② 某科研小组在反应温度503K~543K,反应压强分别是3、4、5、6、7MPa,n(CO)/n(CO+CO2)=0.5的情况下计算了二甲醚的平衡收率(二甲醚实际产量与反应物总量之比),结果如图1所示。

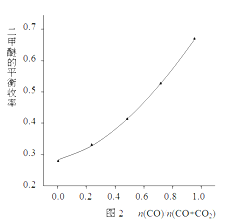
a~e曲线分别对应不同的压强条件,则e对应的压强是______,理由是___________。
该科研小组在反应温度523K、反应压强5MPa的条件下,按照合成反应的化学计量比进料,改变n(CO)/n(CO+CO2)的比例,二甲醚的平衡收率的变化规律如图2所示。
由图2可知,二甲醚的平衡收率随着n(CO)/n(O+CO2)比值的增大而单调上升,其原因是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗结肠炎药物有效成分M的合成路线如下(部分反应略去试剂和条件)

已知:①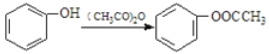 ②
②
(1)烃A的名称是_________________,G中的官能团名称是_______________________。
(2)反应①的反应条件是__________________,反应②的反应类型是_____________________。
(3) E与足量NaOH溶液反应的化学方程式是______________________________________。
(4)符合下列条件的D的同分异构体有_______种。其中核磁共振氢谱有4组峰且峰面积之比为6:2:1:1的结构简式是_____________________。(写出一种即可)
①属于芳香族化合物且苯环上有3个取代基
②能和NaHCO3溶液反应产生气体
(5)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A 为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A 为原料合成化合物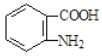 的合成路线_______________
的合成路线_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平下列方程式
①___FeCl3 +___KI===____FeCl2+____KCl+_____I2
②____ClO-+_____Fe(OH)3+_____OH-===_____Cl-+____FeO![]() +____H2O
+____H2O
(2)用浓硫酸配制稀硫酸的过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是___(填序号)。
①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液并定容
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com