
常温下,下列叙述不正确的是
| A.pH=2的盐酸与pH=12的KOH溶液,水电离的c(H+)浓度相等 |
| B.分别将pH=2的盐酸和醋酸溶液稀释到pH=4,后者加入水的体积大 |
| C.在含有AgBr沉淀的悬浊液中加入少量NaBr固体,c(Br-)增大 |
| D.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH一定等于7 |
D
解析试题分析:A、水是弱电解质,存在电离平衡,因此pH=2的盐酸与pH=12的KOH溶液中氢离子和OH-的浓度是相同的,则水电离被抑制的程度是相同的,所以水电离的c(H+)浓度相等,都等于10-12mol/L,A正确;B、醋酸是弱酸,存在电离平衡,稀释促进电离,所以分别将pH=2的盐酸和醋酸溶液稀释到pH=4,后者加入水的体积大,B正确;C、在含有AgBr沉淀的悬浊液中加入少量NaBr固体,使溴化银的溶解平衡向析出溴化银的方向移动,但最终溶液中c(Br-)增大,C正确;D、同浓度、同体积的强酸与强碱溶液混合后,由于不能确定酸碱的元数,因此反应后溶液的pH不一定等于7,D不正确,答案选D。
考点:考查水的电离、溶液稀释、溶解平衡以及酸碱中和后溶液酸碱性的判断


科目:高中化学 来源: 题型:单选题
物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其PH依次为10、9、8,则HX、HY、HZ的酸性由强到弱的顺序是( )
| A.HX>HZ>HY | B.HZ>HY>HX | C.HX>HY>HZ | D.HY>HX>HZ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是用未知浓度的NaOH溶液来滴定10mL盐酸(标准液)所得的曲线(25℃),则下列说法不正确的是( )
| A.标准液盐酸的浓度为0.1 mol/L |
| B.NaOH溶液的浓度为0.05 mol/L |
| C.滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高 |
| D.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为: c(Na+)>c(CH3COO-)>c(0H-)>c(H+),该溶液可能是
| A.由pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合而成 |
| B.由1mL0.1 mol·L-1CH3COOH溶液与10 mL 1 mol·L-1的NaOH溶液混合而成 |
| C.由0.1mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合而成 |
| D.由0.1 mol·L-1的CH3COONa溶液与0.1 mol·L-1的NaOH溶液等体积混合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,Na2CO3溶液中存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
| A.稀释溶液,水解平衡常数增大 | B.通入CO2,平衡向正反应方向移动 |
C.升高温度, 减小 减小 | D.加入NaOH固体,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在0.1 mol·L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+。对于该平衡,下列叙述正确的是
CH3COO-+H+。对于该平衡,下列叙述正确的是
| A.加水,反应速率增大,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.滴加少量0.1 mol·L-1HCl溶液,溶液中c(H+)减少 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于溶液的下列说法正确的是( )
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
| C.往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中增大 |
| D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为( )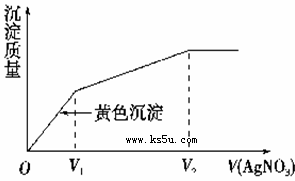
| A.(V2-V1)/V1 | B.V1/V2 |
| C.V1/(V2-V1) | D.V2/V1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com