
【题目】CO2在工业中有重要的用途,请回答:
I.用CrO3作催化剂,CO2重整乙烷(C2H6)制乙烯(C2H4)的反应过程如下:
①C2H6(g)![]() C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;
②3H2(g)+2CrO3(s) =3H2O(g)+Cr2O3(s) ΔH2;
③Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3;
(1)反应C2H6(g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)向2L的恒容密闭容器中充入0.1molC2H6(g)和0.1molCO2(g),发生(1)中反应,C2H6(g)的平衡转化率[a(C2H6)]与温度(T)的关系如图所示。
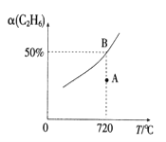
①在相应温度下,A点的反应速v(正)____v(逆)(填“>”、“<”或“=”)。
②若不考虑副反应的发生,为提高α(C2H6),除了将生成物及时从体系中分离出来外,还可采取的措施有___________(任写一种)。
Ⅱ.在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(3)该反应为_________反应(填“吸热”、“放热”),原因为_________________。
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内v(H2)=________,转化率α(CO2)=___________。
【答案】![]() > 适当升高温度(或适当减小压强或增大起始时CO2与C2H6的投料比等其他合理答案) 吸热 温度升高,平衡常数增大,平衡正向移动,则正反应吸热 0.05mol/(Ls) 50%
> 适当升高温度(或适当减小压强或增大起始时CO2与C2H6的投料比等其他合理答案) 吸热 温度升高,平衡常数增大,平衡正向移动,则正反应吸热 0.05mol/(Ls) 50%
【解析】
I.(1)根据盖斯定律计算;
(2)①图象可知曲线上的点为平衡点,A点位于曲线下,达到平衡需要增大乙烷的转化率;
②为提高C2H6的平衡转化率,平衡正向进行。
II.(3)根据表中数据分析,温度升高,化学平衡常数增大,说明温度升高促进反应正向进行;
(4)根据v=![]() 计算H2的消耗速率,由α=
计算H2的消耗速率,由α=![]() ×100%计算CO2的平衡转化率。
×100%计算CO2的平衡转化率。
I.(1)①C2H6(g)![]() C2H4(g) + H2(g) ΔH1;
C2H4(g) + H2(g) ΔH1;
②3H2(g) + 2CrO3(s) = 3H2O(g) + Cr2O3(s) ΔH2;
③Cr2O3(s) + 3CO2(g) = 3CO(g) + 2CrO3(s) ΔH3;
盖斯定律计算![]() (①×3+②+③)得到反应:C2H6(g)+CO2(g)
(①×3+②+③)得到反应:C2H6(g)+CO2(g)![]() C2H4(g)+CO2(g)+H2O(g)的△H=
C2H4(g)+CO2(g)+H2O(g)的△H=![]() ;
;
(2)①C2H6的平衡转化率与温度的关系图分析可知,A点位于平衡曲线下方,未达到化学平衡,若达到平衡状态需要增大乙烷的转化率,所以反应正向进行,A点的反应速率v(正)>v(逆);
②若不考虑副反应的发生,为提高C2H6的平衡转化率,除了将生成物及时从体系中分离出来外,还可采取的措施有:适当升高温度或适当减小压强或增大起始时CO2与C2H6的投料比等。
II.(3)根据表中数据分析,温度升高,化学平衡常数增大,说明升高温度,促进反应正向进行,则正反应为吸热反应;
(4)在2L密闭容器中发生反应CO2(g)+H2(g)![]() CO(g)+H2O(g),在反应开始时n(CO2)=n(H2)=2mol,假设反应产生H2O的物质的量为x,则根据物质反应转化关系可知平衡时的物质的量:n(CO2)=n(H2)=(2-x)mol,n(CO)=n(H2O)=xmol,由于反应前后气体的物质的量相等,在830℃下,K=1.0,所以K=
CO(g)+H2O(g),在反应开始时n(CO2)=n(H2)=2mol,假设反应产生H2O的物质的量为x,则根据物质反应转化关系可知平衡时的物质的量:n(CO2)=n(H2)=(2-x)mol,n(CO)=n(H2O)=xmol,由于反应前后气体的物质的量相等,在830℃下,K=1.0,所以K=![]() =
=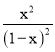 =1.0,解得x=1mol,则这段时间内v(H2)=
=1.0,解得x=1mol,则这段时间内v(H2)=![]() =0.05mol/(Ls),此时CO2的转化率α(CO2)=
=0.05mol/(Ls),此时CO2的转化率α(CO2)=![]() ×100%=50%。
×100%=50%。


科目:高中化学 来源: 题型:
【题目】在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀。最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
A.2912kJB.2953kJC.3236kJD.3867kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________。若电解电路中通过2 mol电子,MnO2的理论产量为________。
(4)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:_____________。用离子方程式表示吸收池中除去NO的原理:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解Na2SO4溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。下列说法正确的是( )
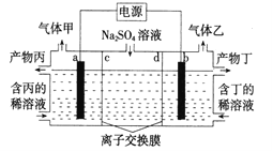
A.b 极与电源的正极相连
B.产物丙为NaOH 溶液
C.离子交换膜d 为阴离了交换膜(允许阴离子通过)
D.a 电极反应式为2H2O-4e-=4H++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 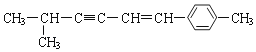 说法正确的是
说法正确的是
A.该分子中所有的碳原子均可能处于同一平面上
B.该分子中一定共面的碳原子数至少为8个
C.该分子中至少有9个碳原子处于同一条直线上
D.该分子中可能处于同一平面的原子总数最多为18个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是一种常见的弱酸,请回答:
(1)已知某温度时,醋酸的电离平衡常数Ka=1.6×10-5。
①醋酸的起始浓度为0.010mol/L,平衡时c(H+)=______(提示:醋酸的电离平衡常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010mol/L
②pH=1的醋酸与pH=l的盐酸等体积混合,混合后溶液中c(CH3COO-)=_______。
(2)日常生活中常用醋酸除水垢,但工业锅炉的水垢中常含有CaSO4,需先用________(填化学式)溶液处理,而后用盐酸去除。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年12月15日,全球第一款不依赖专业充电站的双模电动车--比亚迪F3DM双模电动车在深圳正式上市.比亚迪F3DM双模电动车代表着“科技![]() 绿色明天”,运用了众多高新科技,开启了电动车的新时代,同时也实现了中国力量领跑世界.镍镉
绿色明天”,运用了众多高新科技,开启了电动车的新时代,同时也实现了中国力量领跑世界.镍镉![]() 可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:![]() 有关该电池的说法正确的()
有关该电池的说法正确的()
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应:![]()
C.放电时负极附近溶液的酸性增强
D.放电时电解质溶液中的![]() 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水![]() 含
含![]() 、
、![]() 、
、![]() 、
、![]() 的装置如图所示
的装置如图所示![]() 、b为石墨电极
、b为石墨电极![]() ,下列说法正确的是
,下列说法正确的是
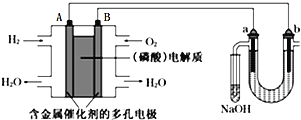
A.电池工作时,B极反应式为![]()
B.电解时,电子流动路径是:A极![]() 外电路
外电路![]() 极
极![]() 溶液
溶液![]() 极
极![]() 极
极
C.NaOH溶液充分吸收后所得溶液可制作漂白水
D.当电池中消耗![]() 标准状况
标准状况![]() 时,a极周围也会产生
时,a极周围也会产生![]() 标准状况
标准状况![]() 气体
气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com