
【题目】如下图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是
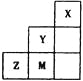
A. 非金属性:![]()
B. 离子半径:![]()
C. ZM2分子中各原子的最外层均满足8电子稳定结构
D. 三种元素中,Y的最高价氧化物对应的水化物酸性最强
【答案】C
【解析】
根据元素在周期表中的相对位置可知,X为He元素,Y为F元素、M为Cl元素、Z为S元素。A、Y、M同主族,原子序数:Y<M,则非金属性:Y>M;Z、M同周期,原子序数:Z<M,则非金属性:Z<M,所以非金属性大小为:M>Z>Y,选项A错误;B、Z、M位于第三周期,其阴离子比Y多1个电子层,且原子序数:Z<M,则离子半径大小为:Z2->M->Y-,选项B错误;C、Z为S、M为Cl元素,则ZM2为SCl2,SCl2分子中S和Cl都达到8电子稳定结构,选项C正确;D、Y为F元素,F没有正化合价,三种元素中,最高价氧化物对应的水化物酸性最强的为Cl,选项D错误。答案选C。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】分类是化学学习与研究的常用方法,下列分类正确的是( )
A.SiO2、SO2、SO3均属于酸性氧化物
B.H2SiO3、H2SO3、H2SO4均属于强酸
C.根据是否具有丁达尔效应,将分散系分为溶液、胶体和浊液
D.根据是否能导电,将物质分为电解质和非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(s)。2 min时该反应达到平衡,生成了0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
xC(g)+2D(s)。2 min时该反应达到平衡,生成了0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
A. x=1
B. 平衡时B与C的浓度之比为3∶2
C. 平衡时A与B的转化率相等,均为40%
D. 平衡时加入少量D可提高该反应的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验乙烯性质的实验,请回答下列问题:

(1)A中碎瓷片的作用是________。
(2)B装置中反应的化学方程式为__________。
(3)C装置中可观察到的现象是_________。
(4)查阅资料.乙烯与酸性高锰酸钾溶液反应产生二氧化碳,根据本实验中装置_____(填装置字母)中的实验现象可判断该资料是否直实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是_______(填字母,下同),除去甲烷中乙烯的方法是___。
A 气体通入水中 B 气体通过盛溴水的洗气瓶
C 气体通过盛酸性高锰酸钾溶液的洗气瓶 D 气体通过氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示, 下列说法中不正确的是( )
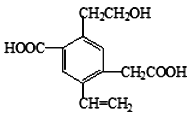
A. 1mol该有机物和过量的金属钠反应最多可以生成1.5 molH2
B. 该有机物消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
C. 可以用酸性KMnO4溶液检验其中的碳碳双键
D. 该有机物能够在催化剂作用下发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是__________(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=_________时,这类们机物开始出现同分异构休。
(3)B与乙醇反应的化学方程式为_____________,反应类型为_______________。
(4)以A为原料可直接生产一种高分子化合物P,则P的结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是中学化学实验室的常见药品,回答下列问题:
I.配制一定物质的量浓度的硫酸溶液:
(1)某次实验大约需要1mol·L-1硫酸溶液435mL。同学们发现实验室内没有450mL的容量瓶,某同学提议用200mL和250mL容量瓶各一个来配制,你认为该提议___________(填“合理”、“不合理”)。
(2)实验中要配制0.5mol·L-1 H2SO4溶液250mL。则需量取密度为1.84g·mL-1、98%的浓硫酸________ml。
Ⅱ.蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,会对环境造成污染。某实验小组利用如下装置对该实验进行改进。回答下列问题:
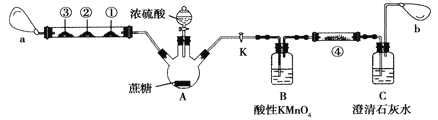
注:硬质玻璃管中①、②、③处分别为滴有Na2S溶液的滤纸、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
(1)图中盛装浓硫酸的仪器名称为______________。
(2)实验开始后先关闭活塞K,硬质玻璃管中①号试纸变黄,②号和③号滤纸均褪色,a处气球变大。硬质玻璃管中实验现象说明炭化实验产生的刺激性气味气体是 SO2,①、②、③处发生的变化分别说明SO2具有____________、____________和____________(填SO2表现出的性质)。
(3)打开活塞K, a处气球变小,b处气球变大。使三颈烧瓶内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊。为证明有CO2生成,可以在④号位罝的滤纸滴加_____________溶液,该试剂的作用是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
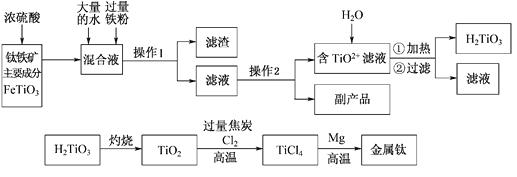
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有________________________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_____________________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是___________________________________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是_____________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com