
����Ŀ�������������������й㷺����;���Իش����л��⣺
��1����Ũ��������������������������Ũ�����________�ԡ�
��2����ҵ����ȡ����ͭ������ͭ��ϡ�����ϣ�ͨ����������м��ȣ���д���÷�Ӧ�Ļ�ѧ����ʽ_____________________��������ͭ��Ũ���ᷴӦ����ȡ����ͭ��ԭ����__________________________________��
��3��һ������п�뺬 a mol H2SO4��Ũ��Һ��ַ�Ӧ��п��ȫ�ܽ⣬ͬʱ�ռ���SO2��H2�Ļ������bL����״����������Ӧ�����Һϡ����1L�������Һ��c��H+��Ϊ c mol/L����������SO2���ʵ���Ϊ______mol��
���𰸡���ˮ�� 2Cu+O2+2H2SO4==2CuSO4+2H2O ���ɵ���CuSO4��H2SO4�϶࣬������SO2��Ⱦ���� ![]()
��������
��1������Ũ��������Խ��
��2�����������£�Cu��������Ӧ����CuO��������������ᷴӦ�����κ�ˮ��ͭ��Ũ���ᷴӦ���ɶ����������Ⱦ������
��3��Zn��Ũ���ᷢ����Ӧ��Zn+2H2SO4��Ũ��=ZnSO4+SO2��+H2O�����ŷ�Ӧ�Ľ��У���ҺŨ�ȼ�С��ϡ������Zn������Ӧ��Zn+H2SO4��ϡ��=ZnSO4+H2�������ݷ�Ӧ���йط���ʽ����غ㷨�����㡣
��1����Ũ�������Ͳ���桰���֡�������Ũ�������ˮ�ԣ�
��2�����������£�Cu��������Ӧ����CuO��CuO��ϡ������������ͭ����˹�ҵ����ȡ����ͭ������ͭ��ϡ�����ϣ�ͨ����������м��ȣ��÷�Ӧ�Ļ�ѧ����ʽΪ2Cu+O2+2H2SO4��2CuSO4+2H2O��Ũ�����ͭ��Ӧ����ʽΪ��Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O�����ɵ���������ͭʱ��Ҫ����϶������ɵĶ���������Ⱦ���������Բ�����ͭ��Ũ���ᷴӦ����ȡ����ͭ��
CuSO4+SO2��+2H2O�����ɵ���������ͭʱ��Ҫ����϶������ɵĶ���������Ⱦ���������Բ�����ͭ��Ũ���ᷴӦ����ȡ����ͭ��
��3��������������ʵ���Ϊ![]() ����Һ��������Ũ����c mol����ʣ����������ʵ���Ϊ0.5c mol���μӷ�Ӧ��n��H2SO4��=a mol-0.5c mol�����ŷ�Ӧ�Ľ��У������Ũ����С���跴Ӧ����x mol SO2��y mol H2�����ݷ���ʽZn+2H2SO4��Ũ��=ZnSO4+SO2��+H2O��Zn+H2SO4��ϡ��=ZnSO4+H2����֪2x+y=a��0.5c������Ϊx+y��b/22.4�����x��
����Һ��������Ũ����c mol����ʣ����������ʵ���Ϊ0.5c mol���μӷ�Ӧ��n��H2SO4��=a mol-0.5c mol�����ŷ�Ӧ�Ľ��У������Ũ����С���跴Ӧ����x mol SO2��y mol H2�����ݷ���ʽZn+2H2SO4��Ũ��=ZnSO4+SO2��+H2O��Zn+H2SO4��ϡ��=ZnSO4+H2����֪2x+y=a��0.5c������Ϊx+y��b/22.4�����x��![]() �����������SO2���ʵ���Ϊ
�����������SO2���ʵ���Ϊ![]() mol��
mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ�����ĩ��Ʒ���ܺ���Fe2O3��Cu2O�е�һ�ֻ����֣�ijУ��ѧ����̽��ʵ��С���������ɽ���̽�����������ϣ�Cu2O��������Һ�лᷢ����Ӧ��Cu2O��2H��=Cu��Cu2����H2O��
ʵ��̽��һ��ѧ����������ͼ��ʾװ�ý���ʵ�飬������Ӧǰ��װ��C����Ʒ����������ȷ����Ʒ����ɡ��ش��������⣺

��1��������װ��ɺк�ֹˮ�У�__________________________________����˵��װ��A�����������á�
��2������ʵ�鲽���У���ȷ�IJ���˳����____________(�����)��
�ٴ�ֹˮ�У���Ϩ��C���ľƾ���ƣ���C����ȴ�����ºر�ֹˮ�У��ܵ�ȼC���ľƾ���ƣ����ռ��������鴿
ʵ��̽������
��3��ѧ����ȡ������Ʒ���ձ��У��������ϡ���ᣬ���������¼�����жϣ�������ȷ���� ______��
A��������ȫ���ܽ⣬˵����Ʒ��һ������Fe2O3��һ��������Cu2O
B�������岿���ܽ⣬˵����Ʒ��һ������Cu2O��һ��������Fe2O3
C��������ȫ���ܽ⣬�ٵμ�KSCN��Һ����Һ�����ɫ��˵����Ʒһ������Fe2O3��Cu2O
D��������ȫ���ܽ⣬�ٵμ�KSCN��Һ����Һ���ɫ��˵����Ʒһ������Fe2O3
��ȡ������Ʒ���Թ��У�����������Ũ���ᣬ��������ɫ���壬֤����Ʒ��һ������________��д��������������Ļ�ѧ����ʽ��____________________��
ʵ��̽������
��4��ѧ����ȡһ������Ʒ���ձ��У�����������ϡ���ᣬ��Ӧ���˵õ�����6.400g�������Һ��Fe2����2.000mol������Ʒ��n(Cu2O)��________________________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4���ƵĻ�����W��X��Y��Z������֮��������¹�ϵ��
��W![]() X��H2O��CO2������Z��CO2�D��X��O2
X��H2O��CO2������Z��CO2�D��X��O2
��Z��H2O�D��Y��O2������X��Ca(OH)2�D��Y��CaCO3��
�Իش��������⣺
��1��W��X��Y��Z�Ļ�ѧʽ�ֱ���W__________��X__________��Y__________��Z__________��
��2������4����ѧ��Ӧ������������ԭ��Ӧ����________(�Ӧ���)����Ӧ�е���������____________(д��ѧʽ)����ԭ����____________(д��ѧʽ)��
��3������Ӧ������Һ�н��У�д�������ӷ���ʽ�Լ����ø����ӷ���ʽ��ʾ����һ����ѧ��Ӧ�Ļ�ѧ����ʽ��
�����ӷ���ʽ��________________��
�ڻ�ѧ����ʽ��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ����ũҩ�����õ��ԭ�������й�Ʒ�İ�ȫ����,�����ũҩ��������ɵ���̬������Σ����������ȷ���ǣ� ��
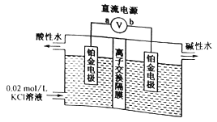
A. aΪֱ����Դ�ĸ�������֮�����ĵ缫������ B. ���ӽ���ĤΪ�����ӽ���Ĥ
C. ������ˮ������ǿ������,����ɱ��Ч�� D. ������ӦʽΪ��H2O--2e-=H2��+O2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�ء��Ӻ�������ȡ��Ĺ�ҵ������������,����˵����������

A. ���̢ٵķ��뷽���ǹ��ˣ���Ҫ�õ��IJ���������©�������������ձ�
B. ����NaOH��Һ��Ŀ����ʹ�������л����γɳ���
C. �����������п���ѡ����ˮ��Ϊ������
D. ���̢��ڹ�ҵ�ϳ�������ȡ��Һ�ķ����õ��ⵥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��(��Ҫ�ɷ�CuFeS2)����ȡCu����Ҫԭ�ϡ�
��֪��2CuFeS2+4O2![]() Cu2S+3SO2+2FeO����
Cu2S+3SO2+2FeO����
����Cu2S��1200 ������¼�����Ӧ��2Cu2S+3O2==2Cu2O+2SO2 ����
2Cu2O+Cu2S==6Cu +SO2�� ������
�ٶ�������Ӧ����ȫ��������˵����ȷ����
A. ��Ӧ����CuFeS2������ԭ��
B. ȡ12.5g��ͭ����Ʒ�����ⶨ��3.60g���������CuFeS2��������һ��Ϊ82.8%
C. ��6molCuFeS2����6molCu����O2�����ʵ���Ϊ14.25mol
D. 6molCuFeS2��15.75molO2��Ӧ�������Ͽɵõ�ͭ�����ʵ���Ϊ3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͭ��Ũ��������ڼ��������·������·�Ӧ(��Ӧ����ʽ����ƽ)��Cu+2H2SO4(Ũ)![]() CuSO4+A��+2H2O���������������⣺
CuSO4+A��+2H2O���������������⣺
(1)A���ʿ��Ե���������γɡ���AӦ������______(����ĸ������д)
a���� b�� �� c���� d������������ e������������
(2)�÷�Ӧ�б�������Ԫ����_________________���μӷ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ______��
(3)д���÷�Ӧ�Ļ�ѧ����ʽ����˫���ű������ת�Ƶķ������Ŀ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���� 0.10 molL-1��NaOH��Һ��ε��뵽20.00 mL 0.10 mol L-1������Һ�У���Һ�е�pH������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ��

�����й��жϴ�����ǣ� ��
A. ���¶��£������Ka��������Ϊl0-5 B. N���Ӧ��NaOH��Һ�������Ϊ20.0mL
C. ��Һ�У�ˮ�ĵ���̶�N���Q��� D. R����ʾ��Һ��c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(FeCr2O4)�к���Al2O3��Fe2O3�����ʣ��Ը�����Ϊԭ���Ʊ��ظ����(K2Cr2O7)�Ĺ�������ʾ��ͼ����(���ֲ�����������)��

(1)������(FeCr2O4)��дΪ���������ʽΪ___________________��
(2)��Ӧ���з�����������Ҫ��Ӧ������һ����Ҫ��Ӧ�Ļ�ѧ����ʽΪ4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2����һ����Ҫ��Ӧ�Ļ�ѧ����ʽΪ ______________________________��
8Na2CrO4+2Fe2O3+8CO2����һ����Ҫ��Ӧ�Ļ�ѧ����ʽΪ ______________________________��
(3)д����Ӧ�������ɹ���B�����ӷ���ʽΪ_________________________________��
(4)pH < 5ʱ��������Ӧ��__________________��д���ӷ���ʽ����Na2Cr2O7 + 2KCl = K2Cr2O7��+ 2NaCl��
�±���������ʵ��ܽ�����ݣ�
���� | �ܽ�� | ( g / 100 g H2O ) | |
0�� | 40�� | 80�� | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
�ټ���KCl�����һϵ�в�������K2Cr2O7�����������___________________________��
�ڻ��K2Cr2O7����IJ����ɶಽ��ɣ������Ǽ���KCl���塢����Ũ����________________��_____________��ϴ�ӡ�����õ����塣
(5)ij�־ƾ��������У�K2Cr2O7�����������½��Ҵ�����Ϊ���ᣬ��������ԭΪ���۸����ӣ��÷�Ӧ���������뻹ԭ�������ʵ�����Ϊ_________________��
(6)��������(��ˮ)�������ŷŶ��������ɻ����м����Σ������ⷨ�Ǵ�������Ⱦ��һ�ַ��������ʱ������������Fe(OH)3��Cr(OH)3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com