
����Ŀ��������(FeCr2O4)�к���Al2O3��Fe2O3�����ʣ��Ը�����Ϊԭ���Ʊ��ظ����(K2Cr2O7)�Ĺ�������ʾ��ͼ����(���ֲ�����������)��

(1)������(FeCr2O4)��дΪ���������ʽΪ___________________��
(2)��Ӧ���з�����������Ҫ��Ӧ������һ����Ҫ��Ӧ�Ļ�ѧ����ʽΪ4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2����һ����Ҫ��Ӧ�Ļ�ѧ����ʽΪ ______________________________��
8Na2CrO4+2Fe2O3+8CO2����һ����Ҫ��Ӧ�Ļ�ѧ����ʽΪ ______________________________��
(3)д����Ӧ�������ɹ���B�����ӷ���ʽΪ_________________________________��
(4)pH < 5ʱ��������Ӧ��__________________��д���ӷ���ʽ����Na2Cr2O7 + 2KCl = K2Cr2O7��+ 2NaCl��
�±���������ʵ��ܽ�����ݣ�
���� | �ܽ�� | ( g / 100 g H2O ) | |
0�� | 40�� | 80�� | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
�ټ���KCl�����һϵ�в�������K2Cr2O7�����������___________________________��
�ڻ��K2Cr2O7����IJ����ɶಽ��ɣ������Ǽ���KCl���塢����Ũ����________________��_____________��ϴ�ӡ�����õ����塣
(5)ij�־ƾ��������У�K2Cr2O7�����������½��Ҵ�����Ϊ���ᣬ��������ԭΪ���۸����ӣ��÷�Ӧ���������뻹ԭ�������ʵ�����Ϊ_________________��
(6)��������(��ˮ)�������ŷŶ��������ɻ����м����Σ������ⷨ�Ǵ�������Ⱦ��һ�ַ��������ʱ������������Fe(OH)3��Cr(OH)3
���𰸡�FeO��Cr2O3 Na2CO3+ Al2O3 ![]() 2NaAlO2 + CO2��AlO2�� + CH3COOH + H2O = Al(OH)3��+ CH3COO��2CrO42-+2H+
2NaAlO2 + CO2��AlO2�� + CH3COOH + H2O = Al(OH)3��+ CH3COO��2CrO42-+2H+ ![]() Cr2O72-+H2OK2Cr2O7���ܽ�ȱ�Na2Cr2O7С�����¶ȶ��Ȼ��Ƶ��ܽ��Ӱ���С�������ظ���ص��ܽ��Ӱ��ϴ����ø��ֽⷴӦ�ڵ����¿��Եõ��ظ������ȴ�ᾧ����2: 32.0��10��12
Cr2O72-+H2OK2Cr2O7���ܽ�ȱ�Na2Cr2O7С�����¶ȶ��Ȼ��Ƶ��ܽ��Ӱ���С�������ظ���ص��ܽ��Ӱ��ϴ����ø��ֽⷴӦ�ڵ����¿��Եõ��ظ������ȴ�ᾧ����2: 32.0��10��12
��������
������(FeCr2O4)�к���Al2O3��Fe2O3�����ʣ�����̼���Ʋ�ͨ�������̼���ڿ����б������õ�Fe2O3��Na2CrO4��NaAlO2�Ļ�����ˮ���˺�ú�Na2CrO4��NaAlO2�Ļ����Һ�����������Һ����pH=7~8����Ӧ�ù���BΪAl(OH)3��������ҺB�к���Na2CrO4������������pH��5��������Ӧ2CrO42-+2H+ ![]() Cr2O72-+H2O����K2Cr2O7���ܽ�Ƚ�С������KCl��Na2Cr2O7ת������K2Cr2O7��
Cr2O72-+H2O����K2Cr2O7���ܽ�Ƚ�С������KCl��Na2Cr2O7ת������K2Cr2O7��
(1).�������и�Ԫ��Ϊ+3�ۣ���Ԫ��Ϊ+2�ۣ�����FeCr2O4�ɸ�дΪ���������ʽΪFeO��Cr2O3���ʴ�Ϊ��FeO��Cr2O3��
(2).��������ͼ�����ƶϣ���Ӧ������һ����Ҫ��Ӧ�Ļ�ѧ����ʽΪNa2CO3+ Al2O3 ![]() 2NaAlO2 + CO2�����ʴ�Ϊ��Na2CO3+ Al2O3
2NaAlO2 + CO2�����ʴ�Ϊ��Na2CO3+ Al2O3 ![]() 2NaAlO2 + CO2����
2NaAlO2 + CO2����
(3).��Ӧ���м��������AlO2��������Ӧ����Al(OH)3�������������ɹ���B�����ӷ���ʽΪAlO2�� + CH3COOH + H2O = Al(OH)3��+ CH3COO�����ʴ�Ϊ��AlO2�� + CH3COOH + H2O = Al(OH)3��+ CH3COO����
(4).pH < 5ʱ��CrO42-��ת��ΪCr2O72-�����ӷ���ʽΪ2CrO42-+2H+ ![]() Cr2O72-+H2O���ʴ�Ϊ��2CrO42-+2H+
Cr2O72-+H2O���ʴ�Ϊ��2CrO42-+2H+ ![]() Cr2O72-+H2O��
Cr2O72-+H2O��
�� .�ɱ������ݿ�֪��K2Cr2O7���ܽ�ȱ�Na2Cr2O7С�����¶ȶ��Ȼ��Ƶ��ܽ��Ӱ���С�������ظ���ص��ܽ��Ӱ��ϴ������¶ȵĽ���K2Cr2O7���ܽ��Ѹ�ٽ��Ͳ�����������Һ�еĸ��ֽⷴӦƽ�ⱻ���ƣ���Ӧ���ҽ��У��Ӷ����ø��ֽⷴӦ�ڵ����¿��Եõ��ظ�������ʴ�Ϊ��K2Cr2O7���ܽ�ȱ�Na2Cr2O7С�����¶ȶ��Ȼ��Ƶ��ܽ��Ӱ���С�������ظ���ص��ܽ��Ӱ��ϴ����ø��ֽⷴӦ�ڵ����¿��Եõ��ظ������
�� .Ҫ���K2Cr2O7���辭������KCl���塢����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ȣ��ʴ�Ϊ����ȴ�ᾧ�����ˣ�
(5).K2Cr2O7�����������½��Ҵ�����Ϊ���ᣬ��������ԭΪ���۸����ӣ��÷�Ӧ�����ӷ���ʽΪ2Cr2O72����3CH3CH2OH��16H��=3CH3COOH��4Cr3����11H2O���ɷ�Ӧ����ʽ��֪���������뻹ԭ�������ʵ�����Ϊ2: 3���ʴ�Ϊ��2: 3��
(6). �������Һ��c(Cr3+)Ϊ3.0��10-5 mol/L��������Һ��c��OH����=![]() ����c(Fe3��)=
����c(Fe3��)=![]() ������c(Fe3��)=
������c(Fe3��)=![]() ��c(Cr3+)=
��c(Cr3+)=![]() ��3.0��10-5 mol/L=2.0��10-12 mol/L���ʴ�Ϊ��2.0��10-12��
��3.0��10-5 mol/L=2.0��10-12 mol/L���ʴ�Ϊ��2.0��10-12��


 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������й㷺����;���Իش����л��⣺
��1����Ũ��������������������������Ũ�����________�ԡ�
��2����ҵ����ȡ����ͭ������ͭ��ϡ�����ϣ�ͨ����������м��ȣ���д���÷�Ӧ�Ļ�ѧ����ʽ_____________________��������ͭ��Ũ���ᷴӦ����ȡ����ͭ��ԭ����__________________________________��
��3��һ������п�뺬 a mol H2SO4��Ũ��Һ��ַ�Ӧ��п��ȫ�ܽ⣬ͬʱ�ռ���SO2��H2�Ļ������bL����״����������Ӧ�����Һϡ����1L�������Һ��c��H+��Ϊ c mol/L����������SO2���ʵ���Ϊ______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������A�е�Ũ����μӵ�ʢ��MnO2����ƿ�У����Ⱥ��������������ͨ��װ��B��C��Ȼ����ͨ�����ȵ�ʯӢ������D(����������)����ش��������⣺
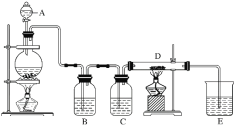
(1)����A��������________����ƿ�з�Ӧ�Ļ�ѧ����ʽ��___________��
(2)װ��B��ʢ��Һ����_______������ͨ��װ��B��Ŀ����___________��
װ��C��ʢ�ŵ�Һ����________������ͨ��װ��C��Ŀ����____________��
(3)D�з�Ӧ�Ļ�ѧ����ʽ��__________________��
(4)�ձ�E��ʢ�ŵ�Һ����________����Ӧ�Ļ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������й�����ƿ��ʹ�÷����IJ����У��������_________��
A��ʹ������ƿǰ������Ƿ�©ˮ
B������ƿ������ˮϴ�������ô�����Һ��ϴ
C������ʱ��������ˮС�ĵ�������ƿ�е��̶�����ƽ��
D��������Һʱ�����������Һ�壬����Ͳ��ȡ������ֱ�ӵ�������ƿ�ж���
E���Ǻ�ƿ������ʳָ��סƿ������һֻ����סƿ�ף�������ƿ�������µߵ���ҡ�ȡ�
��2��ʵ��������2mol/L��Na2CO3��Һ950mL������ʱӦѡ������ƿ�Ĺ��ͳ�ȡNa2CO3�������ֱ���______________��
A��1000mL�� 212g B��950mL��543.4g
C�������� 572g D��500mL�� 106g
��3������98%���ܶ�Ϊ1.8g/mL��Ũ��������500mL��ϡ���ᡣ��ش��������⣺
������ϡ����ʱ����Ҫ�IJ��������в��������ձ�����Ͳ����ȱ�ٵIJ���������_______(��д��������)��
�ھ����㣬����500mL0.2mol/L��ϡ������Ҫ����Ũ��������Ϊ___________��
��ϡŨ����ʱ��ʵ��������裺____________________��
��4�����
������Ͳ��ȡŨ����ʱ���Ӷ������������ս��______(�ƫ��ƫС�����䡱)��
�ڶ���ʱ���Ӷ������������ս��__________(�ƫ��ƫС�����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijKCl��Ʒ�к�������K2CO3��K2SO4�Ͳ�����ˮ�����ʣ�Ϊ���ᴿKCl���Ƚ���Ʒ��������ˮ�У����衢���ˣ��ٽ���Һ����ͼ��ʾ��������ᴿ�����˲�������ȥ��������˵������ȷ����

A. ��ʼ��Һ������pH��7 B. �Լ���ΪBaCl2��Һ
C. ��ͼ���̱��뾭2�ι��� D. �����Ŀ���dz�ȥCO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��;�㷺����ҵ�Ͽ�ͨ���������̺ϳɶ��ʴ������������֪��R-OH + SOCl2 �� R-Cl + SO2 ��+ HCl�� ��ش�

��1��д��B�Ĺ����ŵĵ���ʽ________________________��
��2��д���й����ʵĽṹ��ʽ��A_________________��_________________��
��3��ָ����Ӧ���ͣ���_________________��
��4��д�����л�ѧ����ʽ����Ӧ��______________����Ӧ��___________��
��5���ٶ��ʴ������������Ҷ����ѣ�������ṹ�ж�����˵����ȷ����____(�����)��
a. ������ˮ b. �е�ϸ� c. ����ȼ��
��E��ͬ���칹��ܶ࣬д�������ܹ�����������Ӧ�������칹��Ľṹ��ʽ_________________��
(6)��д����1-�ȱ���ϳɱ�ͪ�ĺϳ�·��ͼ��ע����Ӧ����(���Լ���ѡ)________���ϳ�·������ͼʾ�����£�CH3CH2OH![]() CH2��CH2
CH2��CH2![]() Br��CH2CH2��Br
Br��CH2CH2��Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ԭ��Ӧ�ĵ���ת����Ŀ�ͷ���д��������
(1)Al2(SO4)3+3H2 ![]() Al2O3 +3SO2 +3H2O ����ת��_______ ��������______
Al2O3 +3SO2 +3H2O ����ת��_______ ��������______
(2)6KMnO4 +5KI +3H2O= 6KOH+6MnO+5KIO3 ����ת��_____________�� ��������_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״̬�£���̬���ӶϿ�1 mol��ѧ�����ʱ��Ϊ���ʡ���֪H��H��H��O��O===O���ļ�����H�ֱ�Ϊ436 kJ��mol��1��463 kJ��mol��1��495 kJ��mol��1�������Ȼ�ѧ����ʽ��ȷ����
A. H2O(g)===H2��1/2O2(g)��H����485 kJ��mol��1
B. H2O(g)===H2(g)��1/2O2(g) ��H����485 kJ��mol��1
C. 2H2(g)��O2(g)===2H2O(g) ��H����485 kJ��mol��1
D. 2H2(g)��O2(g)===2H2O(g) ��H����485 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ױƷ�����Z��������Ч��ԭ����������ȡ���ֿ������·�Ӧ�Ʊ���

���������������
A. X��Y��Z����ʹ��ˮ��ɫ
B. X��Z������NaHCO3��Һ��Ӧ�ų�CO2
C. Y���ܷ���ȡ����Ӧ��Ҳ�ܷ����ӳɷ�Ӧ
D. Y�����Ӿ۷�Ӧ���壬X�������۷�Ӧ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com