
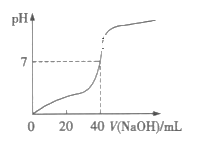
【题目】常温下,用1.0mol·L-1的NaOH溶液中和某浓度的H2SO4溶液,所得溶液的pH和所用NaOH溶液体积的关系如图所示,则原H2SO4溶液的物质的量浓度及完全反应后溶液的体积(忽略反应前后溶液体积的变化)分别是( )
A.1.0mol·L-1,20mLB.0.5mol·L-1,40mL
C.0.5mol·L-1,80mLD.1.0mol·L-1,80mL
【答案】C
【解析】
从图中可以看出,混合溶液pH=7时,消耗NaOH溶液的体积为40mL,则混合溶液的体积必定大于40mL。
A.由分析知,混合溶液的体积不可能为20mL,A不符合题意;
B.由分析知,混合溶液的体积不可能为40mL,B不符合题意;
C.混合溶液体积为80mL时,H2SO4溶液为40mL,若其浓度为0.5mol·L-1,则n(H+)=0.5mol·L-1×2×0.04L=0.04mol,n(OH-)=1.0mol·L-1×0.04L=0.04mol,酸碱刚好完全反应,C符合题意;
D.混合溶液体积为80mL时,H2SO4溶液为40mL,若其浓度为1.0mol·L-1,则n(H+)=1.0mol·L-1×2×0.04L=0.08mol,n(OH-)=1.0mol·L-1×0.04L=0.04mol,反应后酸过量,混合溶液的pH<7,D不合题意;
故选C。


科目:高中化学 来源: 题型:
【题目】镁用于照明弹,是因为镁能在空气中燃烧产生耀眼光芒,并发生如下三个反应:
①2Mg+O2![]() 2MgO
2MgO
②3Mg+N2![]() Mg3N2
Mg3N2
③2Mg+CO2![]() 2MgO+C(黑色)。
2MgO+C(黑色)。
关于上述三个反应的叙述不正确的是( )
A.反应①②③的还原剂都是金属镁
B.反应①和③中都是氧元素被还原
C.反应②的生成物中氮元素为-3价
D.反应③的氧化剂是二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________。此方案第一步的实验装置如图所示:
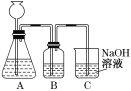
(2)加入反应物前,如何检验整个装置的气密性:___________。
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是___________,作用是:_________。
(4)在实验室通常制法中,装置A还可作为下列_________(填序号)气体的发生装置。
①HCl ②H2 ③Cl2
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_____mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )
cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )

A.达到平衡后,若使用催化剂,C的体积分数增大
B.达到平衡后,若使温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>c+f
D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2的工艺如下:
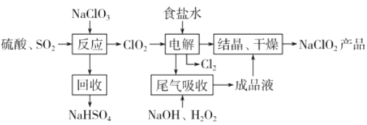
己知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为___,该新方法最突出的优点是___。
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③___;④低于60℃干燥,得到产品。
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶势、充分反应后(ClO2-被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.25mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度___。(提示:2Na2S2O3+I2=Na2S4O6+2Nal)
(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定25℃各含氯微粒浓度随pH的变化情况如图所示(Cl-没有画出)。
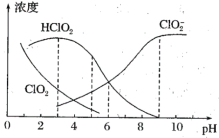
①酸性条件下NaClO2溶液中存在的Cl-原因是___(用离子方程式解释)。
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,A、B、C、D为短周期主族元素,其中A、B、C在周期表中所处的位置如图所示,且它们的质子数之和为32。D元素原子的最外层电子数为次外层电子数的2倍。下列说法正确的是

A.原子半径:D>A>CB.常温常压下,B单质为固态
C.气态氢化物热稳定性:B>CD.C的最高价氧化物的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素是元素周期表中第IIIB族钪、钇和镧系元素的总称。第三代永磁体材料——钕铁硼(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高新技术产业。回答下列问题:
(1)基态Fe原子的价电子排布式为____;铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同,则晶格能NiO____(填“>”“<”或“=”)FeO。
(2)氨硼烷化合物(![]() )是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为___(填化学式);氨硼烷分子中N、B原子的杂化方式分别为___、___。
)是一种新型化学储氢材料,与该化合物分子互为等电子体的有机物为___(填化学式);氨硼烷分子中N、B原子的杂化方式分别为___、___。
(3)![]() 俗称摩尔盐,相对于
俗称摩尔盐,相对于![]() 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(II)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。______
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(II)的标准溶液,试分析硫酸亚铁铵晶体中亚铁离子稳定存在的原因。______
(4)钕是最活泼的稀土金属之一,晶体为六方晶系,钕原子以六方最密堆积方式连接。晶胞参数:![]() 。每个晶胞含有___个钕原子,设阿伏加德罗常数为
。每个晶胞含有___个钕原子,设阿伏加德罗常数为![]() ,则金属钕的密度为___
,则金属钕的密度为___![]() (Nd的相对原子质量为M,列出计算表达式)
(Nd的相对原子质量为M,列出计算表达式)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com